Wasserstoff
Wasserstoff hat drei Hauptisotope: Protium (1H), Deuterium (2H) und Tritium (3H). Diese Isotope entstehen in der Natur. Protium und Deuterium sind stabil. Tritium ist radioaktiv und hat eine Halbwertszeit von etwa 12 Jahren. Wissenschaftler haben vier weitere Wasserstoffisotope (4H bis 7H) erzeugt, aber diese Isotope sind sehr instabil und kommen in der Natur nicht vor.
Die Hauptisotope des Wasserstoffs sind einzigartig, weil sie die einzigen Isotope sind, die einen Namen haben. Diese Namen sind auch heute noch in Gebrauch. Deuterium und Tritium erhalten manchmal ihre eigenen Symbole D und T. Die International Union of Pure and Applied Chemistry mag diese Namen jedoch nicht besonders, obwohl sie häufig verwendet werden. Es gibt andere Isotope, die ihre eigenen Namen hatten, als Wissenschaftler die Radioaktivität untersuchten. Aber ihre Namen werden heute nicht mehr verwendet.
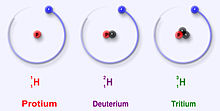
Die drei stabilsten Isotope des Wasserstoffs
Protium (Wasserstoff-1)
Protium ist das häufigste Isotop von Wasserstoff. Es macht mehr als 99,98% des gesamten Wasserstoffs im Universum aus. Es wird Protium genannt, weil sein Kern nur ein Proton enthält. Protium hat eine Atommasse von 1,00782504(7) u. Das Symbol für Protium ist 1H.Das Proton von Protium ist in einer Beobachtung nie zerfallen, so dass Wissenschaftler glauben, dass Protium ein stabiles Isotop ist. Neue Theorien der Teilchenphysik sagen voraus, dass ein Proton zerfallen kann, aber dieser Zerfall ist sehr langsam. Dem Proton wird eine Halbwertszeit von 1036 Jahren nachgesagt. Wenn der Protonenzerfall wahr ist, dann sind alle anderen Kerne, von denen man sagt, dass sie stabil sind, in Wirklichkeit nur beobachtend stabil, d.h. sie sehen aus, als seien sie stabil. Kürzlich durchgeführte Experimente haben gezeigt, dass ein Protonenzerfall eine Halbwertszeit von 6,6 × 1033 Jahren haben würde.
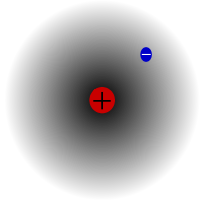
Protium, das häufigste Isotop von Wasserstoff. Das Besondere daran ist, dass es das einzige Isotop ist, das kein Neutron besitzt.
Deuterium (Wasserstoff-2)
Deuterium, oder 2H oder manchmal D, ist ein weiteres stabiles Isotop von Wasserstoff. Das Isotop hat ein Proton und ein Neutron. Es macht etwa 0,0026 - 0,0184% aller Wasserstoffatome auf der Erde aus. Deuterium ist auf der Erde weniger in Wasserstoffgas und mehr in Meerwasser enthalten (0,015% oder 150 ppm). Deuterium ist nicht radioaktiv, und es schadet Lebewesen nicht. Deuterium kann auch Wassermoleküle bilden. Wasser, das Deuterium anstelle von Protium enthält, wird als schweres Wasser bezeichnet.
Tritium (Wasserstoff-3)
Tritium (3H) ist das stabilste Radioisotop des Wasserstoffs. Das heißt, von allen radioaktiven Isotopen des Wasserstoffs ist Tritium das am wenigsten radioaktive. Es hat ein Proton und 2 Neutronen in seinem Kern. Tritium zerfällt durch Beta-minus-Zerfall und verwandelt sich in Helium-3. Es hat eine Halbwertszeit von 12,32 Jahren.Tritium entsteht auf natürliche Weise durch die Wechselwirkung zwischen den Gasen in der oberen Atmosphäre und der kosmischen Strahlung. Es entsteht auch bei Kernwaffentests. Tritium und Deuterium wird bei der D-T-Kernfusion in Sternen verwendet, um viel Energie abzugeben.
Fragen und Antworten
F: Wie viele Hauptisotope von Wasserstoff gibt es?
A: Es gibt drei Hauptisotope von Wasserstoff: Protium, Deuterium und Tritium.
F: Sind Protium und Deuterium stabile Isotope?
A: Ja, Protium und Deuterium sind stabile Isotope.
F: Was ist die Halbwertszeit von Tritium?
A: Tritium ist radioaktiv und hat eine Halbwertszeit von etwa 12 Jahren.
F: Wie viele andere Wasserstoffisotope haben Wissenschaftler geschaffen?
A: Die Wissenschaftler haben vier weitere Wasserstoffisotope geschaffen: 4H bis 7H.
F: Kommen diese vier zusätzlichen Wasserstoffisotope in der Natur vor?
A: Nein, diese Isotope sind sehr instabil und kommen in der Natur nicht vor.
F: Was macht die Hauptisotope des Wasserstoffs so einzigartig?
A: Die Hauptisotope des Wasserstoffs sind einzigartig, weil sie die einzigen Isotope sind, die einen Namen haben.
F: Haben Deuterium und Tritium ihre eigenen Symbole?
A: Ja, Deuterium und Tritium erhalten manchmal ihre eigenen Symbole: D und T. Die International Union of Pure and Applied Chemistry hält jedoch nicht viel von diesen Namen, auch wenn sie oft verwendet werden.
Suche in der Enzyklopädie