Übergangszustand
Bei einer chemischen Reaktion ist der Übergangszustand der Punkt, an dem ein maximaler Energiewert vorliegt. Diese Energie wird als Aktivierungsenergie bezeichnet. Wenn zwei oder mehr Moleküle gemischt werden, treffen sie aufeinander. Wenn sie mit genügend Energie auftreffen, um den Übergangszustand zu durchlaufen, reagieren sie und bilden neue Moleküle. Im Übergangszustand werden neue Bindungen gebildet, während die alten gebrochen werden. In einem Diagramm oder einer Zeichnung wird der Übergangszustand oft mit dem Doppel-Dolch-Symbol ‡ gekennzeichnet.
Es ist sehr schwierig, einen Übergangszustand zu studieren. Das liegt daran, dass er eine so hohe Energie hat, dass die Moleküle für eine sehr kurze Zeit, normalerweise Femtosekunden, in dieser Form bleiben. Es ist wichtig, Übergangszustände nicht mit Zwischenprodukten zu verwechseln. Zwischenprodukte befinden sich an Punkten mit minimaler Energie und können sehr lange leben. Wie ein Übergangszustand befindet sich ein Zwischenprodukt jedoch zwischen Reagenzien und Produkten einer Reaktion.
Die Untersuchung von Übergangszuständen ist sehr wichtig, um Reaktionsmechanismen zu verstehen. Es gibt Theorien und Computerprogramme, mit denen man berechnen kann, wie der Übergangszustand aussieht. Dies ist ein Teil der chemischen Kinetik.
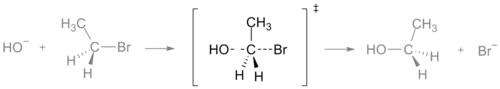
Der Übergangszustand einer SN2-Reaktion
Fragen und Antworten
F: Was ist der Übergangszustand bei einer chemischen Reaktion?
A: Der Übergangszustand ist der Punkt, an dem bei einer chemischen Reaktion ein maximaler Energiewert erreicht wird.
Q: Was ist die Aktivierungsenergie bei einer chemischen Reaktion?
A: Die Energie, die erforderlich ist, damit eine Reaktion abläuft, wird als Aktivierungsenergie bezeichnet.
Q: Was passiert, wenn zwei oder mehr Moleküle in einer chemischen Reaktion gemischt werden?
A: Wenn zwei oder mehr Moleküle gemischt werden, stoßen sie aneinander. Wenn sie mit genügend Energie aufeinander treffen, um den Übergangszustand zu durchlaufen, reagieren sie und bilden neue Moleküle.
Q: Wofür wird das Symbol des Doppelkreuzes (‡) in einem Diagramm oder einer Zeichnung einer chemischen Reaktion verwendet?
A: Das Symbol des Doppelkreuzes (‡) wird verwendet, um den Übergangszustand in einem Diagramm oder einer Zeichnung einer chemischen Reaktion zu markieren.
F: Warum ist es schwierig, den Übergangszustand in einer chemischen Reaktion zu untersuchen?
A: Es ist sehr schwierig, den Übergangszustand in einer chemischen Reaktion zu untersuchen, weil er so energiereich ist, dass die Moleküle nur für eine sehr kurze Zeit, in der Regel Femtosekunden, in dieser Form verbleiben.
F: Was ist ein Zwischenprodukt bei einer chemischen Reaktion?
A: Ein Zwischenprodukt ist ein Molekül, das bei einer chemischen Reaktion am Energieminimum zu finden ist und sehr lange leben kann.
F: Warum ist das Studium von Übergangszuständen wichtig für das Verständnis von Reaktionsmechanismen?
A: Das Studium von Übergangszuständen ist wichtig für das Verständnis von Reaktionsmechanismen, weil es hilft zu bestimmen, wie eine Reaktion abläuft und wie man sie kontrollieren oder manipulieren kann.
Suche in der Enzyklopädie