Molekül
Ein Molekül ist die kleinste Menge einer chemischen Substanz, die existieren kann. Würde man ein Molekül in kleinere Stücke spalten, wäre es ein anderer Stoff.
Moleküle setzen sich aus Atomen zusammen, die in einer bestimmten Form oder Gestalt aneinander geklebt sind. Nicht alle Kombinationen von Atomen sind gleichermaßen möglich; Atome bilden bestimmte Formen bevorzugt gegenüber anderen. Außerdem haben sie eine unterschiedliche Wertigkeit. Zum Beispiel haben Sauerstoffatome immer zwei Bindungen mit anderen Atomen, Kohlenstoffatome haben immer vier Bindungen mit anderen Atomen und Stickstoffatome haben immer drei Bindungen mit anderen Atomen.
In der kinetischen Theorie der Gase wird der Begriff Molekül oft für jedes gasförmige Teilchen unabhängig von seiner Zusammensetzung verwendet. Nach dieser Definition werden Edelgasatome als Moleküle betrachtet, da sie in Wirklichkeit monoatomare Moleküle sind.
In Gasen wie Luft fliegen die Moleküle einfach umher. In Flüssigkeiten wie Wasser sind die Moleküle aneinander geklebt, aber sie können sich noch bewegen. In Feststoffen wie Zucker können die Moleküle nur schwingen. Im vierten Aggregatzustand der Materie, dem Plasma, sind die Atome ionisiert und können keine Moleküle bilden.
Mit einer Summenformel können Sie die Anzahl aller Atome in einem Molekül aufschreiben. Die Summenformel von Glucose lautet zum Beispiel C6H12O6. Das bedeutet, dass ein Glucosemolekül aus sechs Kohlenstoffatomen, zwölf Wasserstoffatomen und sechs Sauerstoffatomen besteht.
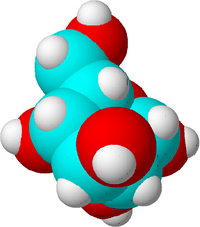
Dies ist ein Zuckermolekül. Kohlenstoffatome werden blau, Sauerstoffatome rot und Wasserstoffatome weiß dargestellt, um den Unterschied zu verdeutlichen. In Wirklichkeit haben Atome keine Farbe.
Bonding
Damit ein Molekül existieren kann, müssen die Atome zusammenhalten. Dies geschieht, wenn sich zwei Atome Elektronen teilen. Anstatt nur um ein Atom zu kreisen, kreist das Elektron nun um zwei. Dies nennt man eine kovalente Bindung. Manchmal wird mehr als ein Elektron geteilt. Je mehr Elektronen geteilt werden, desto stärker wird die Bindung und desto stärker kleben die Atome zusammen.
Anleihen können auch auseinandergebrochen werden. Da die meisten Anleihen Energie zur Bildung benötigen, geben sie auch Energie ab, wenn sie gebrochen werden. Doch bevor die meisten Bindungen brechen, muss das Molekül erhitzt werden. Dann beginnen sich die Atome zu bewegen, und wenn sie sich zu viel bewegen, bricht die Bindung. Moleküle, die zum Aufbrechen weniger Energie benötigen, als sie beim Aufbrechen abgeben, werden als Brennstoffe bezeichnet. Zum Beispiel wird eine Kerze einfach nur da sitzen und nichts passiert. Aber wenn Sie ein Streichholz zum Anzünden verwenden, brennt sie lange Zeit. Das Streichholz bringt die Energie zum Aufbrechen der ersten Bindungen, die genug Energie freisetzen, um die darunter liegenden Bindungen aufzubrechen, bis die Kerze abgebrannt ist.
Es gibt auch ionische Bindungen.
Fragen und Antworten
F: Was ist ein Molekül?
A: Ein Molekül ist die kleinste Menge einer chemischen Substanz, die existieren kann. Es besteht aus Atomen, die in einer bestimmten Form zusammengefügt sind.
F: Wie viele Bindungen haben Sauerstoff-, Kohlenstoff- und Stickstoffatome?
A: Sauerstoffatome haben immer zwei Bindungen mit anderen Atomen, Kohlenstoffatome haben immer vier Bindungen mit anderen Atomen und Stickstoffatome haben immer drei Bindungen mit anderen Atomen.
F: Was besagt die kinetische Theorie der Gase über Moleküle?
A: Nach der kinetischen Theorie der Gase wird der Begriff Molekül häufig für jedes gasförmige Teilchen verwendet, unabhängig von seiner Zusammensetzung. Das bedeutet, dass Edelgasatome als Moleküle betrachtet werden, da sie in Wirklichkeit einatomige Moleküle sind.
F: Wie verhalten sich Moleküle in verschiedenen Zuständen?
A: In Gasen wie Luft fliegen die Moleküle einfach herum. In Flüssigkeiten wie Wasser kleben die Moleküle aneinander, aber sie können sich trotzdem bewegen. In Festkörpern wie Zucker können die Moleküle nur vibrieren. Im Plasma (dem vierten Zustand der Materie) sind die Atome ionisiert und können keine Moleküle bilden.
F: Was ist eine Molekularformel?
A: Eine Molekülformel wird verwendet, um die Anzahl aller Atome in einem Molekül aufzuschreiben. C6H12O6 steht zum Beispiel für ein Molekül Glukose, das aus sechs Kohlenstoffatomen, zwölf Wasserstoffatomen und sechs Sauerstoffatomen besteht.
Suche in der Enzyklopädie