Elektrophil (Chemie): Definition, Eigenschaften und Beispiele
Elektrophil erklärt: Definition, Eigenschaften & typische Beispiele (HCl, Carbonyl, Oxidationsmittel). Lernen Sie, wie Elektrophile Nukleophile in Additions- und Reaktionsmechanismen angreifen.
In der Chemie ist ein Elektrophil ein Molekül oder ein Atom, das gerne Elektronen von einem anderen Reaktionspartner aufnimmt. Elektrophile sind oft positiv geladen oder besitzen zumindest eine elektronenarme Stelle und werden deshalb auch als Lewis-Säuren bezeichnet. Typische Ursachen für Elektronenarmut sind große Unterschiede in der Elektronegativität der beteiligten Atome (beispielsweise in HCl) oder funktionelle Gruppen mit polarisierten Doppelbindungen wie ein Carbonyl. Auch starke Oxidationsmittel verhalten sich oft elektrophil.
Eigenschaften und Ursachen für Elektrophilie
- Ladung: Kationen (z. B. H+, Carbokationen) sind starke Elektrophile, weil sie Elektronen anziehen.
- Polarisation: Polarisierte Bindungen (z. B. C=O) führen zu einem teilpositiven Kohlenstoff, der von Elektronen angezogen wird.
- Induktiver und mesomerer Effekt: Elektronen-ziehende Substituenten erhöhen die Elektrophilie; mesomere Elektronenpaar-Entzug kann die Reaktivität an bestimmten Positionen verstärken.
- Resonanzstabilisierung: Ein Elektrophil, dessen positiver Charakter durch Resonanz verteilt werden kann, ist oft weniger reaktiv, dafür stabiler.
- Solvatisierung und Lösungsmittel: Protolytische Lösungsmittel oder polare Lösungsmittel können Elektrophilie durch Stabilisierung bzw. Abschirmung beeinflussen.
Typische Beispiele für Elektrophile
- Protonen (H+, Säuren wie HCl als Protonendonatoren)
- Carbokationen (R+), z. B. Zwischenstufen bei vielen Additions- und Eliminierungsreaktionen
- Aktivierte Carbonylverbindungen – der karbonylgebundene Kohlenstoff ist elektrophil (Carbonyl)
- Halogene und halogenraktionen (Cl2, Br2) bei elektrophilen Additionen an Doppelbindungen
- Elektronenarme Mehrfachbindungen oder positiv geladene Mehrfachzentren (Nitronium-Ion NO2+, Sulfonium- und Acylium-Ionen)
- Starke Oxidationsmittel, die Elektronen entziehen
Wie reagieren Elektrophile?
Ein Elektrophil wird von einem Nukleophil angegriffen — das Nukleophil liefert ein Elektronenpaar, das sich mit der elektrophilen Stelle verbindet. Typische Reaktionstypen sind:
- Additionsreaktionen an C=C-Doppelbindungen (z. B. elektrophile Addition an Alkene), siehe auch Additionsreaktionen.
- Elektrophile aromatische Substitution, bei der ein Aromat ein Elektrophil angreift und substituiert wird (z. B. Nitration, Sulfonierung, Halogenierung).
- Angriff an Carbonylverbindungen durch Nukleophile (z. B. Nucleophile Addition an Aldehyde/Ketone).
Faktoren, die die Reaktivität beeinflussen
Die Stärke eines Elektrophils hängt von mehreren Variablen ab:
- Elektrische Ladung und deren Delokalisierung
- Elektronen-ziehende oder -schiebende Substituenten in der Nähe der elektrophilen Stelle
- Hybridisierung des angreifenden Atoms (sp2-Kohlenstoffe sind oft elektrophiler als sp3)
- Lösungsmittel und Temperatur — polare Lösungsmittel stabilisieren geladene Zwischenzustände, hohe Temperaturen können Reaktionsgeschwindigkeiten verändern
- HSAB-Prinzip (hard/soft) — harte Elektrophile bevorzugen harte Nukleophile und umgekehrt
Quantitative Beschreibung
Elektrophilie lässt sich auch quantifizieren, z. B. durch Reaktivitätskoeffizienten oder theoretische Kenngrößen wie den Parr-Elektrophilie-Index (ω) oder Fukui-Funktionen aus der Dichtefunktionaltheorie. Solche Größen helfen, Reaktivitäten zwischen verschiedenen Molekülen vorherzusagen.
Praxis und Beispiele im Labor
Im Labor begegnet man Elektrophilen in vielen Reaktionen: Säurekatalysierte Additionen (z. B. Hydratisierung von Alkenen), Halogenierungen, Friedel–Crafts-Acylierungen/Alkylierungen (Bildung von Acylium- bzw. Carbokationen) oder der Angriff auf Carbonylgruppen bei der Synthese von Alkoholen, Estern und Amiden. Beim Arbeiten mit starken Elektrophilen und Oxidationsmitteln sind geeignete Schutzmaßnahmen (Schutzkleidung, Abzug) sowie die Kontrolle von Reaktionsbedingungen wichtig.
Zusammenfassung
Elektrophile sind elektronenarme Moleküle oder Atome, die Elektronenpaare von Nukleophilen aufnehmen. Ihre Stärke hängt von Ladung, Polarisation, Substituenten und Umgebung ab. Typische Beispiele reichen von Protonen und Carbokationen über aktivierte Carbonylverbindungen bis hin zu oxidierenden Spezies. Das Verständnis von Elektrophilen ist zentral für die Beschreibung und Vorhersage vieler organischer und anorganischer Reaktionen.
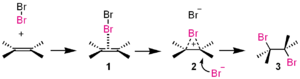
In dieser Additionsreaktion ist Brom (Br2) das Elektrophil
Fragen und Antworten
F: Was ist ein Elektrophil?
A: Ein Elektrophil ist ein Molekül oder ein Atom, das gerne Elektronen von einem anderen aufnimmt.
F: Warum werden Elektrophile auch als Lewis-Säuren bezeichnet?
A: Elektrophile werden auch als Lewis-Säuren bezeichnet, weil sie Elektronenpaare von anderen Molekülen aufnehmen können.
F: Was sind einige Beispiele für Elektrophile?
A: Einige Beispiele für Elektrophile sind Moleküle, deren Atome einen großen Unterschied in der Elektronegativität aufweisen, wie HCl oder ein Carbonyl, oder auch Oxidationsmittel.
F: Wie reagieren Nucleophile mit Elektrophilen?
A: Nucleophile reagieren mit Elektrophilen, indem sie sie angreifen.
F: Was ist ein Nukleophil?
A: Ein Nucleophil ist die entgegengesetzte Art von Molekül zu einem Elektrophil. Es handelt sich um ein Molekül oder ein Atom, das gerne Elektronen abgibt.
F: Wie laufen Additionsreaktionen zwischen Elektrophilen und Nukleophilen ab?
A: Additionsreaktionen treten zwischen Elektrophilen und Nukleophilen auf, wenn das Nukleophil das Elektrophil angreift und eine neue Bindung bildet.
F: Kann ein Elektrophil eine negative Ladung haben?
A: Ein Elektrophil kann eine positive Ladung haben, aber es kann auch eine teilweise positive Ladung oder gar keine Ladung haben. Die wichtigste Eigenschaft ist, dass es bereit ist, Elektronen aufzunehmen.
Suche in der Enzyklopädie