Nukleophilie
Ein Nukleophil ist eine Spezies, die ein Elektronenpaar an ein Elektrophil abgibt, um in einer Reaktion eine chemische Bindung zu bilden. Alle Moleküle oder Ionen mit einem freien Elektronenpaar können Nukleophile sein. Dieses Elektronenpaar wird als freies Elektronenpaar bezeichnet. Da Nukleophile Elektronen spenden, entsprechen sie der Definition der Lewis-Basen.
Nucleophil beschreibt die Anziehung eines Nucleophils auf die Kerne. Nukleophilie, manchmal auch als nukleophile Stärke bezeichnet, bezieht sich auf den nukleophilen Charakter einer Substanz und wird oft verwendet, um die Anziehung von Atomen zu vergleichen.
Neutrale nukleophile Reaktionen mit Lösungsmitteln wie Alkoholen und Wasser werden als "Solvolyse" bezeichnet. Nukleophile können an nukleophilen Substitutionsreaktionen teilnehmen. Bei diesen Reaktionen wird ein Nukleophiler von einer vollständigen oder teilweisen positiven Ladung angezogen.
Geschichte
Die Begriffe Nukleophil und Elektrophil wurden 1929 von Christopher Kelk Ingold eingeführt und ersetzten die zuvor von A. J. Lapworth 1925 vorgeschlagenen Begriffe Kationoid und Anionoid.
Das Wort Nucleophil leitet sich von Nucleus und dem griechischen Wort φιλος, philos for love, ab.
Eigenschaften
Im Allgemeinen gilt: Je basischer das Ion (je höher der pKa-Wert der konjugierten Säure) innerhalb einer Reihe des Periodensystems ist, desto reaktiver ist es als Nukleophil. In einer bestimmten Gruppe ist die Polarisierbarkeit für die Bestimmung der Nukleophilie wichtiger. Mit anderen Worten, je leichter die Elektronenwolke um ein Atom oder Molekül herum verzerrt werden kann, desto reaktionsfreudiger ist sie. Zum Beispiel ist das Jodidion (I-) nukleophiler als das Fluoridion (F-).
Arten von Nukleophilen
Beispiele für Nukleophile sind Anionen wie Cl-, oder eine Verbindung mit einem einzelnen Elektronenpaar wie NH3 (Ammoniak).
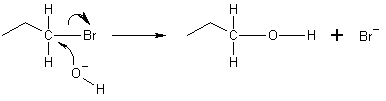
Im Beispiel unten gibt der Sauerstoff des Hydroxidions ein Elektronenpaar ab, das sich mit dem Kohlenstoff am Ende des Brompropanmoleküls verbindet. Die Bindung zwischen dem Kohlenstoff und dem Brom wird dann einer heterolytischen Spaltung unterzogen, wobei das Bromatom das gespendete Elektron aufnimmt und zum Bromidion (Br-) wird. Dies ist eine SN2-Reaktion, die durch Rückseitenangriff erfolgt. Dies bedeutet, dass das Hydroxid-Ion das Kohlenstoffatom von der anderen Seite angreift, genau gegenüber dem Brom-Ion. Aufgrund dieses Rückseitenangriffs führen SN2-Reaktionen zu einer Umkehrung der Konfiguration des Elektrophils. Wenn das Elektrophil chiral ist, behält es typischerweise seine Chiralität, obwohl die Konfiguration des SN2-Produkts im Vergleich zu der des ursprünglichen Elektrophils umgekehrt wird (Walden-Inversion).
Ein ambidentes Nukleophil ist ein Nukleophil, das von zwei oder mehr Orten aus angreifen kann, was zu zwei oder mehr Produkten führt. Zum Beispiel kann das Thiocyanation (SCN-) entweder vom S oder vom N aus angreifen. Aus diesem Grund führt die SN2-Reaktion eines Alkylhalogenids mit SCN- oft zu einer Mischung aus RSCN (einem Alkylthiocyanat) und RNCS (einem Alkylisothiocyanat). Ähnliche Mischungen werden bei der Kolbe-Nitrilsynthese auftreten.
Kohlenstoff-Nukleophile
Alkylmetallhalogenide sind Kohlenstoff-Nukleophile, die in der Grignard-Reaktion, Blaise-Reaktion, Reformatsky-Reaktion und Barbier-Reaktion, Organolithium-Reagenzien und Anionen eines terminalen Alkins vorkommen.
Auch Enole sind Kohlenstoff-Nukleophile. Die Bildung eines Enols wird durch Säure oder Base katalysiert. Enole sind ambidente Nukleophile, aber im Allgemeinen am Kohlenstoffatom neben den Kohlenstoffatomen mit Doppelbindung (Alphakohlenstoffatom) nukleophil. Enole werden häufig in Kondensationsreaktionen verwendet, einschließlich der Claisen-Kondensation und der Aldol-Kondensationsreaktionen.
Sauerstoff-Nukleophile
Beispiele für Sauerstoff-Nukleophile sind Wasser (H2O), Hydroxid-Anion, Alkohole, Alkoxid-Anionen, Wasserstoffperoxid und Carboxylat-Anionen.
Schwefel-Nukleophile
Von den Schwefelnukleophilen werden Schwefelwasserstoff und seine Salze, Thiole (RSH), Thiolat-Anionen (RS-), Anionen von Thiolcarbonsäuren (RC(O)-S-) und Anionen von Dithiocarbonaten (RO-C(S)-S-) und Dithiocarbamaten (R2N-C(S)-S-) am häufigsten verwendet.
Im Allgemeinen ist Schwefel aufgrund seiner großen Größe sehr nukleophil, was ihn leicht polarisierbar macht, und seine einzelnen Elektronenpaare sind leicht zugänglich.
Stickstoff-Nukleophile
Zu den Stickstoff-Nukleophilen gehören Ammoniak, Azid, Amine und Nitrite.
Verwandte Seiten
- Elektrophil
- Lewis-Stützpunkt
Fragen und Antworten
F: Was ist ein Nukleophil?
A: Ein Nukleophil ist eine Spezies, die ein Elektronenpaar an ein Elektrophil abgibt, um in einer Reaktion eine chemische Bindung zu bilden.
F: Welche Arten von Molekülen oder Ionen können nukleophil sein?
A: Alle Moleküle oder Ionen mit einem freien Elektronenpaar können nucleophil sein.
F: Wie nennt man das Elektronenpaar, das Nukleophile abgeben?
A: Das Elektronenpaar wird als einsames Paar bezeichnet.
F: In welche Kategorie fallen Nukleophile?
A: Nukleophile gehören in die Kategorie der Lewis-Basen, da sie Elektronen abgeben.
F: Was beschreibt der Begriff "nukleophil"?
A: Der Begriff "nukleophil" beschreibt die Anziehungskraft eines Nukleophils auf die Atomkerne.
F: Was bedeutet der Begriff "Nukleophilie"?
A: Der Begriff "Nukleophilie" bezieht sich auf den nukleophilen Charakter einer Substanz und wird oft verwendet, um die Anziehung von Atomen zu vergleichen.
Q: Was sind "Solvolysereaktionen"?
A: Neutrale nukleophile Reaktionen mit Lösungsmitteln wie Alkoholen und Wasser werden als "Solvolyse" bezeichnet.
Suche in der Enzyklopädie