Periodensystem
Das Periodensystem der chemischen Elemente ist eine Liste der bekannten chemischen Elemente. In der Tabelle sind die Elemente in der Reihenfolge ihrer Ordnungszahlen angeordnet, beginnend mit der niedrigsten Zahl von eins, Wasserstoff. Die Ordnungszahl eines Elements ist gleich der Anzahl der Protonen in diesem bestimmten Atomkern. Im Periodensystem sind die Elemente in Perioden und Gruppen eingeteilt. Eine Reihe von Elementen quer durch das Periodensystem wird als Periode bezeichnet. Jede Periode hat eine Zahl; von 1 bis 8. Die Periode 1 enthält nur 2 Elemente: Wasserstoff und Helium. Periode 2 und Periode 3 haben beide 8 Elemente. Andere Perioden sind länger. Die Elemente in einer Periode haben aufeinander folgende Ordnungszahlen.
Eine Spalte mit Elementen weiter unten in der Tabelle wird als Gruppe bezeichnet. Im Standard-Periodensystem gibt es 18 Gruppen. Jede Gruppe hat eine Nummer: von 1 bis 18. Elemente in einer Gruppe haben Elektronen, die auf ähnliche Weise angeordnet sind, entsprechend der Anzahl der Valenzelektronen, was ihnen ähnliche chemische Eigenschaften verleiht (sie verhalten sich auf ähnliche Weise). Zum Beispiel wird die Gruppe 18 als Edelgase bezeichnet, weil sie alle Gase sind und sich nicht mit anderen Atomen verbinden.
Es gibt zwei Gruppennummernsysteme; eines mit arabischen Ziffern (1,2,3) und das andere mit römischen Ziffern (I, II, III). Die Namen mit römischen Ziffern wurden im größten Teil des 20. Jahrhunderts verwendet. Im Jahr 1990 beschloss die Internationale Union für reine und angewandte Chemie (IUPAC), das neue System mit arabischen Ziffern zu verwenden, um die beiden alten Gruppennamensysteme mit römischen Ziffern zu ersetzen.
Das Periodensystem wurde von Chemikern verwendet, um Muster und Beziehungen zwischen Elementen zu beobachten. Im Periodensystem gibt es 3 Hauptgruppen: Metalle, Halbmetalle und Nichtmetalle. Zum Beispiel sind die Elemente am unteren und äußersten linken Rand des Periodensystems die metallischsten und die Elemente oben rechts die am wenigsten metallischen. (z.B. Cäsium ist viel metallischer als Helium). Es gibt auch viele andere Muster und Beziehungen.
Das Periodensystem wurde von dem russischen Chemiker Dmitrij IwanowitschMendelejew (1834-1907) erfunden. Ihm zu Ehren wurde das Element 101 nach ihm benannt, Mendelevium.
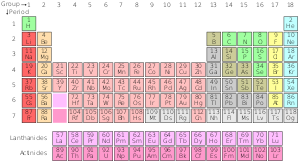
Die Standardvariation des Periodensystems
Standard-Periodensystem
| Gruppe→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | 13 | 14 | 15 | 16 | 17 | ||||
| 1 | 2 | |||||||||||||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||||||||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | ||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | ||
| 6 | 55 | 56 | * Lanthaniden | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | ||
| 7 | 87 Fr | 88 | ** Aktiniden | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | ||
| 8 | 119 Uue | 120 Milliarden | *** Superaktiniden | |||||||||||||||||
| * Lanthanide-Reihe | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** Aktiniden-Reihe | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** Superaktiniden-Reihe | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129Ube | 130Utn | 131Utu | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Superaktiniden-Reihe | 136Uth | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147Uqs | 148Uqo | 149Uqe | 150Upn | |||||
| *** Superaktiniden-Reihe | 151Upu | 152oben | 153Up | 154Upq | 155oben | 156Up | 157Aufwärts | 158Upo | 159Europa | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165Hoch | |||||
| *** Superaktiniden-Reihe | 166Uhh | 167Uhs | 168Uho | 169Uhe | 170Usn | 171Usu | 172Usb | 173Ust | 174Usq | 175Usp | 176Ush | 177Uss | 178Uso | 179Verwendung | 180Uon | |||||
| *** Superaktiniden-Reihe | 181Uou | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Superaktiniden-Reihe | 196Ueh | 197Ues | 198Ueo | 199Uee | 200Bnn | 201Bnu | 202Bnb | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207Bns | 208Bno | 209Bne | 210Bun | |||||
| *** Superaktiniden-Reihe | 211Buu | 212Bub | 213Aber | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220 Mrd. | 221Bbu | 222Bbb | 223Bbt | 224Bbq | 225Bbp | |||||
Chemische Reihen des Periodensystems
- Alkalimetalle
- Erdalkalien
- Lanthaniden
- Aktiniden
- Superaktiniden
- Übergangsmetalle
- Schlechte Metalle
- Nichtmetalle
- Halogene
Zustand bei Standardtemperatur und -druck. Die Farbe der Zahl (Ordnungszahl) über dem Elementsymbol zeigt den Zustand des Elements bei Normalbedingungen an.
- Die blau markierten sind Gase.
- die in grün sind Flüssigkeiten
- die in Schwarz sind solide
- Diejenigen mit festen Grenzen haben stabile Isotope (Primordiale Elemente)
- Diejenigen mit gestrichelten Grenzen haben nur radioaktive, natürlich vorkommende Isotope
- Solche mit gestrichelten Grenzen kommen in der Natur nicht vor (Synthetische Elemente)
- Diejenigen ohne Grenzen sind zu radioaktiv, um noch entdeckt worden zu sein.
Andere Methoden zur Anzeige der chemischen Elemente
Die oben gezeigte Version des Periodensystems ist die am häufigsten verwendete. Andere verbreitete Versionen sind unten dargestellt:
· 
Theodor Benfey arrangierte die Elemente in einer Spirale um Wasserstoff herum. Das Atomgewicht bestimmt die Position des Elements.
· 
Dmitrij Iwanowitsch Mendelejew verwendete ein Blumenarrangement; Aktiniden, Lanthaniden sind als Schleifen neben der Hauptgruppe dargestellt.
· 
Timothy Stove ordnete die Elemente nach der Quantenzahl an.
· ![]()
Betterman ordnete die Elemente nach ihren isoelektrischen Eigenschaften an, die in eine Polynomform umgewandelt werden können.
· 
Dreieckige Version, von Zmaczynski und Bayley
· 
In einer Pyramide angeordnet.
Weniger verwendete Versionen
- Die Standardtabelle liefert die Grundlagen. Sie ist oben dargestellt
- Eine vertikale Tabelle für verbesserte Lesbarkeit in Web-Browsern
- Die große Tabelle enthält die Grundlagen sowie die vollständigen Elementnamen
- Die riesige Tabelle enthält die Grundlagen sowie vollständige Elementnamen und Atommassen
- Elektronen-Konfigurationen
- Metalle und Nichtmetalle
- Liste der Elemente: enthält Name, Symbol, Ordnungszahl, Atommasse, Gruppe und Punkt; sortierbar nach jedem dieser Elemente
- Liste der Elemente nach Symbolen
- Liste der Elemente nach Siedepunkt
- Liste der Elemente nach Schmelzpunkt
- Liste der Elemente nach Dichte
Verwandte Seiten
- Periodensystem-Gruppe
- Periode des Periodensystems
- Erweitertes Periodensystem
Fragen und Antworten
F: Was ist das Periodensystem?
A: Das Periodensystem ist eine Tabelle, in der alle bekannten chemischen Elemente in der Reihenfolge ihrer Ordnungszahl angeordnet sind, beginnend mit Wasserstoff als Nummer eins. Elemente mit ähnlichen Eigenschaften werden oft nebeneinander angeordnet.
F: Wie viele Perioden und Gruppen gibt es im Standard-Periodensystem?
A: Das Standardperiodensystem besteht aus 8 Perioden und 18 Gruppen.
F: Was haben die Elemente einer Periode gemeinsam?
A: Elemente in einer Periode haben aufeinander folgende Ordnungszahlen.
Q: Was haben die Elemente einer Gruppe gemeinsam?
A: Die Elemente einer Gruppe haben eine ähnliche Anordnung der Elektronen, entsprechend der Anzahl der Valenzelektronen, was ihnen ähnliche chemische Eigenschaften verleiht.
F: Wer hat das Periodensystem erfunden?
A: Der russische Chemiker Dmitri Iwanowitsch Mendelejew erfand das Periodensystem (1834-1907).
F: Was sind die drei Hauptgruppen des Periodensystems?
A: Die drei Hauptgruppen des Periodensystems sind Metalle, Metalloide und Nichtmetalle.
F: Wie lassen sich anhand des Periodensystems Muster und Beziehungen zwischen den Elementen beobachten?
A: Muster und Beziehungen zwischen den Elementen lassen sich beobachten, indem man sich ansieht, wo sie im Periodensystem erscheinen; zum Beispiel sind Elemente links unten tendenziell metallischer als solche rechts oben.
Suche in der Enzyklopädie