Carben: Definition, Struktur, Reaktivität und Beispiele
Carben verstehen: Definition, Struktur, Singulett vs. Triplett, Reaktivität und typische Beispiele (u.a. Grubbs‑Katalysator) kompakt und anschaulich erklärt.
Als Carbene bezeichnet man Moleküle, die ein einzelnes Kohlenstoffatom besitzen, das nur zwei σ-Bindungen eingeht und zusätzlich zwei nicht bindende Elektronen trägt. Da der Kohlenstoff damit formal nur sechs Elektronen in seiner Valenzschale hat, sind Carbenen sehr reaktiv. Man schreibt die allgemeine Struktur oft als R-(C:)-R' oder kurz R2C:.
Struktur und elektronische Zustände
Carbene treten in zwei grundsätzlichen elektronischen Zuständen auf: als Singulett- oder als Triplett-Zustand. Bei einem Singulett-Carben bilden die beiden nicht bindenden Elektronen ein gepaartes einsames Paar und besetzen dasselbe Orbital; das verbleibende p-Orbital ist leer. Solche Carbenen sind meist sp2-hybridisiert und zeigen oft eine kompaktere, "gekrümmte" Geometrie. Beim Triplett-Carben sitzen die beiden Elektronen in unterschiedlichen Orbitalen (typischerweise je eines in einem sp2- und eines in einem p-Orbital) und haben parallelen Spin, wodurch das Molekül diradikalischen Charakter erhält. Welcher Zustand bevorzugt wird, hängt stark von Substituenten und deren elektronischen Effekten ab: π-donierende Heteroatome (z. B. N oder O) oder Gruppen, die durch Resonanz ins leere p-Orbital stabilisieren, begünstigen den Singulett-Zustand, während alkylsubstituierte Carbenen eher den Triplett-Zustand zeigen können, weil alkylgruppen Radikalisierung über Hyperkonjugation stabilisieren.
Reaktivität und typische Reaktionen
Carbene sind vielseitige Reagenzien: sie können sowohl elektrophil als auch nukleophil reagieren, je nachdem, ob ihr leerer p-Orbital oder ihr lone pair reaktionsbestimmend ist. Typische Reaktionen sind:
- Addition an Doppelbindungen (z. B. Doppelbindungen) zur Bildung von Cyclopropanen (Cyclopropanierung).
- Insertion in X–H-Bindungen (z. B. C–H- oder O–H-Insertion), wodurch neue C–X-Bindungen entstehen.
- Bildung von Yliden (z. B. Oxonium- oder Phosphoniumyliden) durch Reaktion mit Carbonyl- oder Phosphorverbindungen.
- Cheletropische Reaktionen, bei denen das Carbene gleichzeitig zwei Bindungen zu einem Substrat bildet (cheletropische Reaktionen).
- Dimerisierung zu Alkenen (bei unkontrollierter Reaktivität) oder Umlagerungen und Fragmentierungen.
In der Praxis werden freie Carbenen nicht immer isoliert; häufig werden sie in situ erzeugt und sofort in einer gewünschten Umwandlung genutzt (z. B. bei Cyclopropanierungen oder Insertionsreaktionen). In manchen Fällen werden "Carbenoide" eingesetzt — metallgebundene oder andere Zwischenstufen, die ein ähnliches Reaktivitätsprofil zeigen, etwa beim Simmons–Smith-Verfahren.
Herstellung und Nachweis
Häufige Methoden zur Erzeugung von Carbenen sind:
- Thermische oder photochemische Zersetzung von Diazo-Verbindungen (R2C=N2), wobei Stickstoff (N2) abgespalten wird.
- α-Eliminierung aus Halogenalkanen (z. B. Erzeugung von Dichlorcarben :CCl2 aus Chloroform unter basischen Bedingungen).
- Photolyse von Diazirinen oder ähnlichen Vorstufen.
- Übergangsmetall-vermittelte Erzeugung von Metallcarben-Komplexen (siehe unten).
Zur Charakterisierung werden Kombinationen aus spektroskopischen Methoden (EPR für Triplettzustände, UV/Vis, IR bei Metallcarbenen), Matrixisolation, kinetischen Untersuchungen und theoretischen Rechnungen verwendet. Viele Carbenen konnten nur durch Fallenstellen (Trapping) oder indirekt nachgewiesen werden.
Stabilität, Beispiele und Anwendungen
Die meisten freien Carbenen sind kurzlebig; dennoch gibt es gut stabilisierte bzw. "persistente" Carbenen. Ein wichtiges Beispiel sind die N‑heterocyclischen Carbenen (NHCs), die durch benachbarte Stickstoffsubstituenten stark stabilisiert werden und als sehr nützliche Liganden in der organischen und metallorganischen Chemie dienen. Arduengo‑Carbene sind bekannte isolierbare NHCs.
In der Metallorganischen Chemie unterscheidet man u. a. zwischen Fischer‑ und Schrock‑Carbenen: Fischer‑Carbene sind typischerweise an spätere, niedrigoxidierte Metalle gebunden und verhalten sich elektrophil, Schrock‑Carbene an frühe, höheroxidierte Metalle sind dagegen oft nukleophil. Solche Metallcarbene spielen eine zentrale Rolle in Katalysereaktionen.
Ein berühmtes praktisches Beispiel für ein Metallcarben ist der von Robert Grubbs entwickelte Grubbs‑Katalysator: ein Ruthenium‑Carben‑Komplex, der die Olefin‑Metathese großtechnisch und in der Synthesechemie revolutioniert hat.
Weitere einfache Carbene sind das Methylen (:CH2), das Dichlorcarben (:CCl2) oder verschieden substituierte Carbenen aus Diazo‑Verbindungen. Moderne Forschung beschäftigt sich mit der gezielten Stabilisierung neuer Carbenen, deren reaktionsspezifischer Nutzung und mit Anwendungen in der Katalyse, Materialwissenschaft und organischen Synthese.
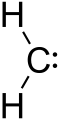
Ein Carbene
Fragen und Antworten
F: Was ist ein Carben?
A: Ein Carben ist ein Molekül mit einem Kohlenstoffatom, das zwei Bindungen eingeht, und zwei weiteren Elektronen, die keine Bindungen eingehen.
F: Warum ist ein Carben reaktiv?
A: Der Kohlenstoff in einem Carben hat nur 6 Elektronen um sich herum, was es sehr reaktiv macht.
F: Wie lautet die allgemeine Formel für ein Carben?
A: Die allgemeine Formel für ein Carben kann als R-(C:)-R' geschrieben werden.
F: Welche zwei Arten von Carbenen gibt es?
A: Die zwei Arten von Carbenen sind Singulett und Triplett.
F: Was ist der Unterschied zwischen einem Singulett- und einem Triplett-Carben?
A: Bei einem Singulett-Carben sind die beiden Elektronen, die keine Bindungen eingehen, wie ein einsames Paar und bleiben im selben Orbital. Bei einem Triplettcarben befinden sich die beiden Elektronen in verschiedenen Orbitalen und haben den gleichen Spin.
F: Welche Reaktionen können Carbene durchführen?
A: Carbene können viele Reaktionen eingehen. Sie können sowohl elektrophil als auch nukleophil sein und sie führen gerne Additionsreaktionen an Doppelbindungen durch. Man findet sie auch bei cheletropen Reaktionen.
F: Sind Carbene stabil?
A: Die meisten Carbene sind sehr instabil, aber einige können für lange Zeit existieren. Ein Beispiel ist der Grubbs-Katalysator, der von Robert Grubbs entwickelt wurde.
Suche in der Enzyklopädie