Sulfoxide
Ein Sulfoxid ist ein Molekül, bei dem ein Schwefelatom an zwei Kohlenstoffe und ein Sauerstoffatom gebunden ist. Es stammt aus der Oxidation von Thioethern, ohne bis zum Sulfon zu gehen. Wie viele schwefelhaltige Moleküle kann Sulfoxid manchmal sehr stark riechen.
Sulfoxide können mit der allgemeinen Formel R-S(=O)-R' geschrieben werden. Schwefel hat eine Doppelbindung mit dem Sauerstoff und Einfachbindungen mit den Kohlenstoffen. Dadurch bleibt ein einsames Paar am Atom zurück. Das bedeutet, dass die Form an diesem Atom tetraedrisch ist. Es bedeutet auch, dass der Schwefel ein chirales Zentrum sein kann. Sulfoxide werden als gute Liganden für Übergangsmetalle verwendet.
Ein wichtiges Molekül dieser Art ist Dimethylsulfoxid. Es wird auch DMSO genannt. Es wird als Lösungsmittel für viele Reaktionen verwendet, insbesondere in der Biochemie.
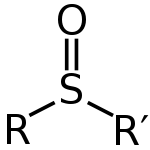
Allgemeine Struktur eines Sulfoxids
Fragen und Antworten
F: Was ist ein Sulfoxid?
A: Ein Sulfoxid ist ein Molekül, bei dem ein Schwefelatom an zwei Kohlenstoffe und ein Sauerstoffatom gebunden ist.
F: Woher kommt Sulfoxid?
A: Sulfoxid entsteht bei der Oxidation von Thioethern, ohne dass der Weg zum Sulfon beschritten wird.
F: Wie lautet die allgemeine Formel für Sulfoxide?
A: Die allgemeine Formel für Sulfoxide lautet R-S(=O)-R'.
F: Welche Form hat das Atom in Sulfoxiden?
A: Die Form des Atoms in Sulfoxiden ist tetraedrisch.
F: Kann Schwefel ein chirales Zentrum in Sulfoxiden sein?
A: Ja, Schwefel in Sulfoxiden kann ein chirales Zentrum sein.
F: Was ist Dimethylsulfoxid und wofür wird es verwendet?
A: Dimethylsulfoxid, auch bekannt als DMSO, ist ein wichtiges Sulfoxidmolekül und wird als Lösungsmittel für viele Reaktionen verwendet, insbesondere in der Biochemie.
F: Warum werden Sulfoxide als gute Liganden für Übergangsmetalle verwendet?
A: Sulfoxide werden als gute Liganden für Übergangsmetalle verwendet, da sie aufgrund des Elektronenpaars am Schwefelatom in der Lage sind, sich mit Metallionen zu koordinieren.
Suche in der Enzyklopädie