Thermochemie
Thermochemie ist die Untersuchung der Energie und Wärme, die mit chemischen Reaktionen und physikalischen Umwandlungen (physikalischen Veränderungen) zusammenhängen. Physikalische Umwandlungen liegen vor, wenn ein Zustand der Materie (z.B. ein fester oder flüssiger Stoff) in einen anderen Zustand übergeht. Beispiele für Transformationen sind das Schmelzen (wenn ein Feststoff zu einer Flüssigkeit wird) und das Sieden (wenn eine Flüssigkeit zu einem Gas wird).
Eine Reaktion gibt Energie ab oder nimmt sie auf. Eine physikalische Umwandlung gibt ebenfalls Energie ab oder nimmt sie auf. Die Thermochemie befasst sich mit diesen Energieänderungen, insbesondere mit dem Energieaustausch eines Systems mit seiner Umgebung. Die Thermochemie ist nützlich bei der Vorhersage von Reaktanten- und Produktmengen zu jeder Zeit während einer bestimmten Reaktion. Thermochemiker tun dies anhand von Daten, einschließlich Entropiebestimmungen. Thermochemiker erkennen, ob eine Reaktion spontan oder nicht-spontan, günstig oder ungünstig verläuft.
Endotherme Reaktionen nehmen Wärme auf. Exotherme Reaktionen geben Wärme ab. Die Thermochemie verbindet die Konzepte der Thermodynamik mit der Vorstellung von Energie in Form von chemischen Bindungen. Sie umfasst Berechnungen solcher Größen wie Wärmekapazität, Verbrennungswärme, Bildungswärme, Enthalpie, Entropie, freie Energie und Kalorien.
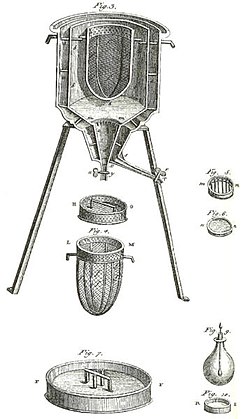
Das erste Eiskalorimeter der Welt, das im Winter 1782-83 von Antoine Lavoisier und Pierre-Simon Laplace verwendet wurde. Es wurde verwendet, um die bei verschiedenen chemischen Veränderungen entstehende Wärme zu ermitteln. Diese Berechnungen basierten auf Joseph Blacks früherer Entdeckung der latenten Wärme. Mit diesen Experimenten begann die Thermochemie.
Geschichte
Die Thermochemie begann mit zwei Ideen:
- Das Gesetz von Lavoisier und Laplace (1780): Die Energieänderung für jede Transformation ist gleich und entgegengesetzt zur Energieänderung für den umgekehrten Prozess.
- Hess' Gesetz (1840): Die Energieänderung für jede Transformation ist gleich, ob sie in einem Schritt oder in vielen Schritten erfolgt.
Diese Entdeckungen gingen dem ersten Hauptsatz der Thermodynamik (1845) voraus. Sie halfen den Wissenschaftlern, dieses Gesetz zu verstehen.
Edward Diaz und Hess untersuchten spezifische Wärme und latente Wärme. Joseph Black entwickelte das Konzept der latenten Energieänderungen.
Gustav Kirchhoff zeigte 1858, dass die Änderung der Reaktionswärme durch den Unterschied in der Wärmekapazität zwischen Produkten und Reaktanten gegeben ist: ∂ Δ H ∂ T = Δ C p {\Darstellungsstil {{\teilweise \Delta H} \über \Teil T}=\Delta C_{p}} 
Kalorimetrie
Die Messung von Wärmeänderungen wird als Kalorimetrie bezeichnet. Sie misst die Wärme von chemischen Reaktionen oder physikalischen Veränderungen. Ein Kalorimeter, ein Gerät für die Kalorimetrie, ist in der Regel eine geschlossene Kammer.
Die Kalorimetrie hat diese Schritte: Chemiker führen die Veränderung innerhalb der Kammer durch. Die Temperatur der Kammer wird entweder mit einem Thermometer oder einem Thermoelement gemessen. Die Temperatur wird gegen die Zeit aufgetragen, um ein Diagramm zu erhalten. Chemiker verwenden die Grafik zur Berechnung grundlegender Größen.
Moderne Kalorimeter verfügen über kleine Computer, die die Temperatur messen und die berechneten Daten schnell ausgeben. Ein Beispiel ist ein Differential-Scanning-Kalorimeter (DSC).
Systeme
Mehrere thermodynamische Definitionen sind in der Thermochemie sehr nützlich. Ein "System" ist der spezifische Abschnitt des Universums, der untersucht wird. Alles außerhalb des Systems wird als Umgebung oder Umwelt betrachtet. Ein System kann das sein:
- ein isoliertes System - wenn es weder Energie noch Materie mit der Umgebung austauschen kann, wie bei einem isolierten Bombenkalorimeter;
- ein geschlossenes System - wenn es Energie, aber keine Materie mit der Umgebung austauschen kann, wie bei einem Dampfheizkörper;
- ein offenes System - wenn es sowohl Materie als auch Energie mit der Umgebung austauschen kann, z.B. einen Topf mit kochendem Wasser.
Prozesse
Ein System durchläuft einen "Prozess", wenn sich eine oder mehrere seiner Eigenschaften (Merkmale) ändern. Ein Prozess bezieht sich (verbindet) mit der Zustandsänderung. Ein isothermer Prozess (gleiche Temperatur) findet statt, wenn die Temperatur des Systems gleich bleibt. Ein isobarer Prozess (gleicher Druck) findet statt, wenn der Druck des Systems gleich bleibt. Ein adiabatischer (kein Wärmeaustausch) Prozess findet statt, wenn sich keine Wärme bewegt.
Verwandte Seiten
- Wichtige Veröffentlichungen in der Thermochemie
- Isodesmische Reaktion
- Prinzip der maximalen Arbeit
- Reaktionskalorimeter
- Thomsen-Berthelot-Prinzip
- Julius Thomsen
- Thermodynamische Datenbanken für Reinstoffe
- Kalorimetrie
- Thermische Physik
Fragen und Antworten
F: Was ist Thermochemie?
A: Die Thermochemie ist die Lehre von der Energie und der Wärme, die bei chemischen Reaktionen und physikalischen Umwandlungen entstehen.
F: Was sind einige Beispiele für physikalische Umwandlungen?
A: Beispiele für physikalische Umwandlungen sind Schmelzen (wenn ein Feststoff zu einer Flüssigkeit wird) und Sieden (wenn eine Flüssigkeit zu einer Flüssigkeit wird).
F: Wie hilft die Thermochemie bei der Vorhersage von Reaktanten- und Produktmengen?
A: Thermochemiker verwenden Daten, einschließlich Entropiebestimmungen, um die Mengen der Reaktanten und Produkte zu jedem Zeitpunkt einer bestimmten Reaktion vorherzusagen.
F: Sind endotherme Reaktionen günstig oder ungünstig?
A: Endotherme Reaktionen sind ungünstig.
F: Sind exotherme Reaktionen vorteilhaft oder ungünstig?
A: Exotherme Reaktionen sind vorteilhaft.
F: Welche Konzepte werden in der Thermochemie kombiniert?
A: Die Thermochemie kombiniert die Konzepte der Thermodynamik mit der Idee der Energie in Form von chemischen Bindungen.
F: Welche Arten von Berechnungen führen Thermochemiker durch?
A: Thermochemiker führen Berechnungen wie Wärmekapazität, Verbrennungswärme, Bildungswärme, Enthalpie, Entropie, freie Energie und Kalorien durch.
Suche in der Enzyklopädie