Benzol (C6H6): Definition, Eigenschaften, Verwendung & Krebsrisiko
Benzol (C6H6): Struktur, Eigenschaften, industrielle Verwendung und Krebsrisiko verständlich erklärt – Risiken, Anwendungen und Schutzmaßnahmen auf einen Blick.
Benzol (auch Benzen genannt) ist eine organisch-chemische Verbindung mit der Formel C6H6. Es ist eine farblose, leicht flüchtige und brennbare Flüssigkeit mit einem schwach süßlichen Geruch. Molekular betrachtet besteht Benzol aus einem Ring von sechs Kohlenstoffatomen, die jeweils an ein Wasserstoffatom gebunden sind; die Elektronen im Ring sind delokalisiert, weshalb Benzol als aromatische Verbindung bezeichnet wird.
Eigenschaften und Struktur
Chemisch zeigt Benzol besondere Stabilität durch Resonanz: statt fester einzelner und doppelter Bindungen sind die π‑Elektronen über den gesamten Ring verteilt. Dadurch sind alle C–C‑Bindungen im Ring nahezu gleich lang. Typische chemische Reaktionen von Benzol sind elektrophile aromatische Substitutionsreaktionen (z. B. Nitrierung, Sulfonierung, Halogenierung, Friedel–Crafts‑Reaktionen). Unter stark reduzierenden Bedingungen kann Benzol zu Cyclohexan hydriert werden.
Vorkommen und Herstellung
Benzol kommt natürlich in Rohöls vor und ist daher auch in Benzin enthalten. Es entsteht zudem bei unvollständiger Verbrennung (z. B. Autoabgase, Tabakrauch, Waldbrände) und kann in geringen Mengen natürlich vorkommen. Industriell wird Benzol vor allem aus Erdölfraktionen gewonnen (z. B. durch katalytisches Reforming, Steam‑Cracking oder Entalkylierung von Toluol) und als Zwischenprodukt in Raffinerien hergestellt.
Verwendung
Benzol ist ein wichtiger Ausgangsstoff in der chemischen Industrie. Es dient als Lösungsmittel (heutzutage seltener wegen der Toxizität) und als Grundbaustein für die Synthese vieler anderer Chemikalien. Beispiele:
- Herstellung von Styrol (Vorprodukt für Polystyrol), Phenol (u. a. für Harze) und Anilin (zur Herstellung von Farbstoffen)
- Produkte für die Kunststoff‑, Gummi‑ und Farbstoffindustrie — entsprechend wird Benzol als Zusatzstoff in Benzin, Kunststoffen, synthetischem Gummi und Farbstoffen verwendet
- Zwischenprodukt für die Herstellung von Agrochemikalien, Detergenzien und zahlreichen Feinchemikalien
Viele Medikamente enthalten Phenylgruppen oder andere Strukturelemente, die chemisch vom Benzolring abgeleitet sind; das bedeutet nicht, dass reines Benzol in Arzneimitteln enthalten ist, wohl aber seine strukturellen Derivate.
Gesundheitsrisiken
Benzol ist krebserregend. Die Internationale Agentur für Krebsforschung (IARC) stuft Benzol als Karzinogen für den Menschen ein. Langfristige oder wiederholte Exposition gegenüber Benzoldämpfen kann das Blutbild stören, das Knochenmark schädigen und das Risiko für chronische Erkrankungen wie Leukämie (insbesondere akute myeloische Leukämie) sowie aplastische Anämie erhöhen. Akute hohe Exposition kann zu Schwindel, Kopfschmerzen, Übelkeit und Bewusstseinsstörungen führen.
Expositionswege sind vor allem Inhalation, aber auch Hautkontakt und bei Verschlucken. Aufgrund der Gesundheitsgefahren ist Benzol in Arbeitsbereichen streng reglementiert; Schutzmaßnahmen, Überwachung und Begrenzung der Einatmungszeit sind wichtig.
Umweltverhalten
Benzol ist relativ flüchtig und kann leicht in die Atmosphäre entweichen. Es entsteht bei Verbrennungsprozessen und trägt zur Luftbelastung bei. In Böden und Grundwasser kann Benzol gelöst vorkommen und gilt dort als schadstoffrelevant; es ist biologisch abbaubar, aber je nach Bedingungen (z. B. sauerstoffarm) kann der Abbau langsam verlaufen. Sanierung kontaminierter Standorte erfolgt durch Verfahren wie Belüftung, biologische Behandlung (Bioremediation) oder technische Auffang‑ und Abscheideverfahren.
Sicherheit und Schutzmaßnahmen
Im Umgang mit Benzol sind technische und organisatorische Schutzmaßnahmen unerlässlich: geschlossene Systeme, gute Belüftung, Explosionsschutz und das Tragen geeigneter persönlicher Schutzausrüstung (Atemschutz, Handschuhe, Schutzbrille). Benzol sollte kühl, trocken und gut belüftet sowie getrennt von Zündquellen gelagert werden. Bei Verschüttung sind kontaminierte Bereiche abzusichern, die Freisetzung zu minimieren und fachgerecht zu entsorgen.
Erste‑Hilfe‑Maßnahmen: Betroffene an die frische Luft bringen, kontaminierte Kleidung entfernen, bei Augenkontakt mit viel Wasser spülen und bei anhaltenden Beschwerden ärztliche Hilfe suchen. Bei Verdacht auf chronische Exposition sollten medizinische Untersuchungen des Blutbildes erfolgen.
Wichtig: Wegen der gesundheitlichen Gefahren sollten Laien keine Experimente mit reinem Benzol durchführen. Bei Fragen zu gesetzlichen Grenzwerten, Beschäftigungsgrenzen oder zur Sanierung kontaminierter Flächen empfiehlt es sich, die jeweils gültigen nationalen Regelungen und Fachstellen (z. B. Berufsgenossenschaften, Umweltämter) zu konsultieren.
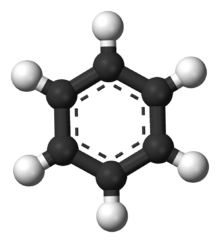
Modell eines Moleküls von Benzol. Kohlenstoffatome sind als schwarz und Wasserstoff als weiß dargestellt.
_1964,_MiNr_440.jpg)
1964 gab die deutsche Post zum Gedenken an 100 Jahre Entdeckung von Benzol eine Briefmarke heraus
Struktur
Benzol hat besondere Eigenschaften, die als Aromatizität bezeichnet werden. Alle sechs Kohlenstoffatome im Ring befinden sich auf der gleichen flachen Ebene. Um alle Bindungen auf einem Sechskohlenstoffring zu berücksichtigen, muss es abwechselnd Kohlenstoff-Doppelbindungen geben (konjugiertes System):
Wenn Benzol drei Doppelbindungen hätte, wären drei Seiten seines Rings kürzer als die anderen drei Seiten. Die Röntgenbeugung zeigt, dass alle sechs Kohlenstoff-Kohlenstoff-Bindungen in Benzol die gleiche Länge von 140 Pikometern (pm) haben. Die C-C-Bindungslängen sind größer als eine Doppelbindung (135 pm), aber kürzer als eine Einfachbindung (147 pm). Dieser Zwischenabstand ist konsistent mit der Elektronen-Delokalisierung: die Elektronen für die C-C-Bindung sind gleichmäßig zwischen jedem der sechs Kohlenstoffatome verteilt. Das Molekül ist planar. Eine Darstellung ist, dass die Struktur als Überlagerung so genannter Resonanzstrukturen existiert, und nicht als eine der beiden Formen einzeln. (Mit anderen Worten: Die Doppelbindungen des Moleküls wechseln schnell zwischen den Kohlenstoffatompaaren). Die Delokalisierung von Elektronen ist eine Erklärung für die thermodynamische Stabilität von Benzol und verwandten aromatischen Verbindungen. Es ist wahrscheinlich, dass diese Stabilität zu den besonderen molekularen und chemischen Eigenschaften beiträgt, die als Aromatizität bekannt sind. Um die delokalisierte Natur der Bindung anzuzeigen, wird Benzol oft mit einem Kreis innerhalb einer hexagonalen Anordnung von Kohlenstoffatomen dargestellt.
Wie in der organischen Chemie üblich, wurden die Kohlenstoffatome im obigen Diagramm nicht beschriftet. Da jeder Kohlenstoff 2p-Elektronen hat, gibt jeder Kohlenstoff ein Elektron in den delokalisierten Ring oberhalb und unterhalb des Benzolrings ab. Es ist die Überlappung der p-Orbitale sowohl oberhalb als auch unterhalb des Rings, die die pi-Wolken erzeugt.
1986 bestritten einige Chemiker in einem Artikel, der in der Zeitschrift Nature veröffentlicht wurde, die Sichtweise der Delokalisierung von Benzol. Sie zeigten, dass die Elektronen im Benzol mit ziemlicher Sicherheit auf bestimmte Kohlenstoffatome lokalisiert sind. Sie zeigten, dass die aromatischen Eigenschaften von Benzol eher auf Spinkopplung als auf Elektronen-Delokalisierung zurückzuführen sind. Andere Wissenschaftler schrieben 1987 in der Zeitschrift Nature Artikel zur Unterstützung dieser Ansicht. Chemiker wechseln jedoch nur langsam von der Ansicht der delokalisierten Elektronen ab.
Derivate von Benzol kommen als Bestandteil organischer Moleküle so häufig vor, dass es im Block "Miscellaneous Technical" ein Unicode-Symbol mit dem Code U+232C (⌬) gibt, um es mit drei Doppelbindungen darzustellen, und U+23E3 (⏣) für eine delokalisierte Version.
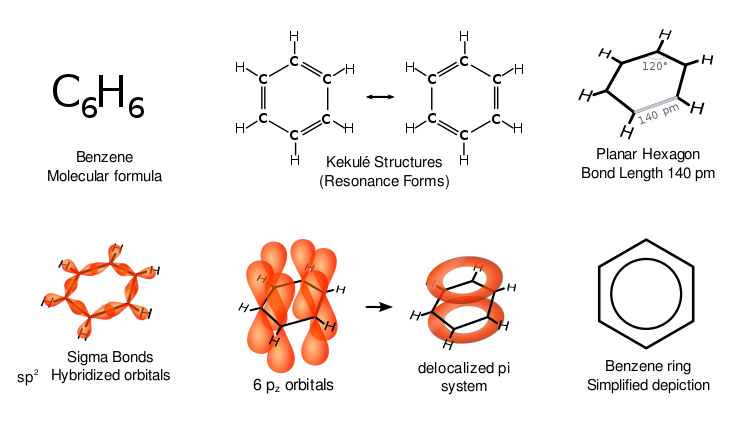
Die verschiedenen Darstellungen von Benzol
Fragen und Antworten
F: Was ist Benzol?
A: Benzol ist eine organische chemische Verbindung.
F: Wie lautet die chemische Formel für Benzol?
A: Die chemische Formel für Benzol lautet C6H6.
F: Wie sieht Benzol aus und wie riecht es?
A: Benzol ist eine farblose und brennbare Flüssigkeit mit einem süßen Geruch.
F: Wie ist die Struktur eines Benzolmoleküls?
A: Ein Benzolmolekül ist ein Ring aus sechs Kohlenstoffatomen, die jeweils an ein Wasserstoffatom gebunden sind. Es ist eine aromatische Verbindung, was bedeutet, dass der Ring abwechselnd Doppelbindungen aufweist.
F: Ist Benzol krebserregend?
A: Ja, Benzol ist krebserregend, das heißt, es kann Krebs verursachen.
F: Wie wird Benzol in der Praxis verwendet?
A: Benzol wird als Zusatzstoff in Benzin, Kunststoffen, synthetischem Kautschuk und Farbstoffen verwendet und ist ein industrielles Lösungsmittel, das heißt, es kann viele andere chemische Moleküle auflösen. Auch viele Medikamente enthalten Bestandteile aus Benzol.
F: Wo kommt Benzol vor?
A: Benzol ist ein natürlicher Bestandteil von Rohöl und kommt daher in Benzin vor.
Suche in der Enzyklopädie