Carbokation
Ein Carbokation ist ein Ion mit einem positiv geladenen Kohlenstoffatom. Das geladene Kohlenstoffatom in einem Carbokation ist ein "Sextett" (d.h. es hat nur sechs Elektronen in seiner äußeren Valenzschale anstelle von acht Valenzelektronen). Kohlenstoffatome mit acht Valenzwahlen haben die höchste Stabilität (Oktett-Regel). Daher sind Carbokationen oft reaktiv und versuchen, das Oktett der Valenzelektronen aufzufüllen und gleichzeitig eine neutrale Ladung zurückzugewinnen. Die Logik würde sagen, dass Carbokationen eine sp3-Hybridisierung mit einem leeren sp3-Orbital aufweisen, was zu einer positiven Ladung führt. Die Reaktivität eines Carbokations ähnelt jedoch eher einer sp2-Hybridisierung mit einer trigonalen planaren Molekülgeometrie.
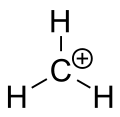
Carbenium-Ion von Methan
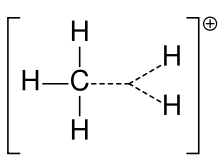
Carbonium-Ion von Methan

tert-Butyl-Kation, zur Demonstration der planaren Geometrie
Definitionen
Ein Carbokation wurde früher oft als Carbonium-Ion bezeichnet, aber Chemiker stellen die genaue Bedeutung in Frage. In der heutigen Chemie ist ein Carbokation jedes positiv geladene Kohlenstoffatom. Es wurden zwei spezielle Typen vorgeschlagen: Carbenium-Ionen sind dreiwertig und Carbonium-Ionen sind fünf- oder sechswertig. In Lehrbüchern auf Universitätsebene werden Carbokationen nur so behandelt, als seien sie Carbenium-Ionen, oder sie werden mit einem flüchtigen Verweis auf den älteren Ausdruck Carbonium-Ion oder Carbenium- und Carbonium-Ionen diskutiert. Ein Lehrbuch bleibt bis heute bei der älteren Bezeichnung Carbonium-Ion für Carbenium-Ion und reserviert die Phrase hypervalentes Carbenium-Ion für CH5+.
Geschichte
Im Jahr 1891 berichtete G. Merling, dass er Tropyliden (Cycloheptatrien) Brom hinzufügte und das Produkt dann erhitzte, um ein kristallines, wasserlösliches Material, C
7H
7Br. Er schlug keine Struktur dafür vor; Doering und Knox zeigten jedoch überzeugend, dass es sich um Tropylium- (Cycloheptatrienylium-) Bromid handelte. Dieses Ion wird nach der Hückel-Regel als aromatisch vorhergesagt.
Im Jahr 1902 entdeckten Norris und Kehrman unabhängig voneinander, dass farbloses Triphenylmethanol in konzentrierter Schwefelsäure tiefgelbe Lösungen ergibt. Triphenylmethylchlorid bildete in ähnlicher Weise orangefarbene Komplexe mit Aluminium- und Zinnchloriden. Adolf von Baeyer erkannte 1902 den salzähnlichen Charakter der gebildeten Verbindungen.

Er nannte die Beziehung zwischen Farbe und Salzbildung Halochromie, wofür Malachitgrün ein Paradebeispiel ist.
Carbokationen sind reaktive Zwischenprodukte in vielen organischen Reaktionen. Diese Idee, die erstmals 1899 von Julius Stieglitz vorgeschlagen wurde, wurde 1922 von Hans Meerwein in seiner Studie über die Wagner-Meerwein-Umlagerung weiterentwickelt. Es wurde auch festgestellt, dass Carbocationen an der SN1-Reaktion, der E1-Reaktion und an Umlagerungsreaktionen wie der Whitmore 1,2-Verschiebung beteiligt sind. Das chemische Establishment zögerte, den Begriff des Carbocations zu akzeptieren, und lange Zeit lehnte das Journal of the American Chemical Society Artikel ab, in denen sie erwähnt wurden.
Das erste NMR-Spektrum eines stabilen Carbokations in Lösung wurde 1958 von Doering et al. veröffentlicht. Es handelte sich um das Heptamethylbenzoloniumion, das durch Behandlung von Hexamethylbenzol mit Methylchlorid und Aluminiumchlorid hergestellt wurde. Das stabile 7-Norbornadienyl-Kation wurde von Story et al. 1960 durch Reaktion von Norbornadienylchlorid mit Silbertetrafluoroborat in Schwefeldioxid bei -80 °C hergestellt. Im NMR-Spektrum wurde festgestellt, dass es nicht klassisch überbrückt war (das erste stabile, nicht klassische Ion, das beobachtet wurde).
1962 beobachtete Olah direkt das tert-Butyl-Carbokation durch kernmagnetische Resonanz als stabile Spezies beim Auflösen von tert-Butylfluorid in magischer Säure. Die NMR des Norbornyl-Kations wurde erstmals von Schleyer et al. berichtet, und Saunders et al. zeigten, dass das Norbornyl-Kation ein Protonen-Scrambling über eine Barriere durchläuft.
Eigenschaften
In der organischen Chemie ist ein Carbokation oft das Ziel eines nukleophilen Angriffs durch Nukleophile wie Hydroxyl- (OH-) Ionen oder Halogenionen.
Carbokationen werden je nach der Anzahl der an den ionisierten Kohlenstoff gebundenen Kohlenstoffatome als primär, sekundär oder tertiär klassifiziert. Primäre Carbokationen haben ein oder null Kohlenstoffatome, die an den ionisierten Kohlenstoff gebunden sind, sekundäre Carbokationen haben zwei Kohlenstoffatome, die an den ionisierten Kohlenstoff gebunden sind, und tertiäre Carbokationen haben drei Kohlenstoffatome, die an den ionisierten Kohlenstoff gebunden sind.
Die Stabilität des Carbokations nimmt mit der Anzahl der an den ladungstragenden Kohlenstoff gebundenen Alkylgruppen zu. Tertiäre Carbokationen sind stabiler (und bilden sich leichter) als sekundäre Carbokationen; primäre Carbokationen sind hochgradig instabil, weil ionisierte Kohlenstoffe höherer Ordnung zwar durch Hyperkonjugation stabilisiert werden, nicht aber unsubstituierte (primäre) Kohlenstoffe. Daher treten Reaktionen wie die SN1-Reaktion und die E1-Eliminierungsreaktion normalerweise nicht auf, wenn sich ein primäres Carbokation bilden würde. Eine Ausnahme bildet der Fall, dass neben dem ionisierten Kohlenstoff eine Kohlenstoff-Kohlenstoff-Doppelbindung vorhanden ist. Solche Kationen wie das Allylkation CH2=CH-CH2+ und das Benzylkation C6H5-CH2+ sind stabiler als die meisten anderen Carbokationen. Moleküle, die Allyl- oder Benzylkationen bilden können, sind besonders reaktiv.
Carbocations durchlaufen Umlagerungsreaktionen von weniger stabilen Strukturen zu gleich stabilen oder stabileren mit Geschwindigkeitskonstanten von über 109/sec. Diese Tatsache erschwert die Synthesewege zu vielen Verbindungen. Wenn z.B. 3-Pentanol mit wässriger HCl erhitzt wird, lagert sich das ursprünglich gebildete 3-Pentyl-Carbokation zu einem statistischen Gemisch aus 3-Pentyl und 2-Pentyl um. Diese Kationen reagieren mit Chloridionen unter Bildung von etwa 1/3 3-Chlorpentan und 2/3 2-Chlorpentan.
Einige Carbokationen, wie das Norbornylkation, weisen eine mehr oder weniger symmetrische Dreizentrenbindung auf. Kationen dieser Art wurden als nicht-klassische Ionen bezeichnet. Der Energieunterschied zwischen "klassischen" Carbokationen und "nicht-klassischen" Isomeren ist oft sehr gering, und im Allgemeinen ist am Übergang zwischen "klassischen" und "nicht-klassischen" Strukturen nur wenig oder gar keine Aktivierungsenergie beteiligt. Die "nicht-klassische" Form des 2-Butylcarbocations ist im wesentlichen 2-Buten mit einem Proton direkt über dem Zentrum der Kohlenstoff-Kohlenstoff-Doppelbindung. Die "nicht-klassischen" Carbokationen waren einst Gegenstand großer Kontroversen. Einer der größten Beiträge von George Olah zur Chemie war die Lösung dieser Kontroverse.
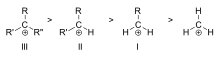
Reihenfolge der Stabilität von Beispielen für tertiäre (III), sekundäre (II) und primäre (I) Alkylcarbocationen
Spezifische Carbokationen
Cyclopropylcarbinyl-Kationen können mittels NMR untersucht werden:

Im NMR-Spektrum eines Dimethylderivats werden für die beiden Methylgruppen zwei nicht-äquivalente Signale gefunden, die anzeigen, dass die molekulare Konformation dieses Kations nicht senkrecht (wie in A), sondern halbiert (wie in B) ist, wobei das leere p-Orbital und das Cyclopropylringsystem in der gleichen Ebene liegen:

In Bezug auf die Theorie der gebogenen Bindungen erklärt sich diese Präferenz durch die Annahme einer günstigen Orbitalüberlappung zwischen den gefüllten Cyclopropan-Bogenbindungen und dem leeren p-Orbital.
Fragen und Antworten
F: Was ist ein Carbokation?
A: Ein Carbokation ist ein Ion mit einem positiv geladenen Kohlenstoffatom.
F: Was ist die äußere Valenzschale eines Carbokations?
A: Die äußere Valenzschale eines Carbokations hat nur sechs Elektronen anstelle der stabilen acht Valenzelektronen.
F: Warum sind Carbokationen oft reaktiv?
A: Carbokationen sind oft reaktiv, weil sie versuchen, das Oktett der Valenzelektronen aufzufüllen und eine neutrale Ladung wiederzuerlangen.
F: Was ist die maximale Stabilität für Kohlenstoffatome?
A: Die maximale Stabilität für Kohlenstoffatome ist erreicht, wenn sie acht Valenzelektronen haben.
F: Was ist ein Sextett in der Chemie?
A: Als Sextett bezeichnet man ein Kohlenstoffatom in einem Carbokation, das in seiner äußeren Valenzschale nur sechs Elektronen statt der stabilen acht Valenzelektronen hat.
F: Was ist die Hybridisierung und Molekülgeometrie eines Carbokations?
A: Obwohl die Logik nahelegen würde, dass Carbokationen eine sp3-Hybridisierung mit einem leeren sp3-Orbital aufweisen, das eine positive Ladung ergibt, ähnelt ihre Reaktivität eher einer sp2-Hybridisierung mit einer trigonal-planaren Molekülgeometrie.
F: Was ist die Oktettregel?
A: Die Oktettregel ist ein Prinzip in der Chemie, das besagt, dass Atome dazu neigen, chemische Bindungen mit anderen Atomen einzugehen, die es beiden Atomen ermöglichen, einen stabilen Satz von acht Valenzelektronen zu besitzen.
Suche in der Enzyklopädie