SN1-Reaktion: Definition, unimolekularer Mechanismus & Beispiele
SN1-Reaktion: Einfacher Leitfaden zu Definition, unimolekularem Mechanismus, Carbokationen & typischen Beispielen (sek./tert. Alkylhalogenide, Alkohole). Verständlich erklärt.
Die SN1-Reaktion ist eine Substitutionsreaktion in der organischen Chemie. "SN" steht für nukleophile Substitution und die "1" repräsentiert die Tatsache, dass der geschwindigkeitsbestimmende Schritt nur ein Molekül (unimolekular) betrifft. Charakteristisch für den Mechanismus ist die Bildung eines Carbokations-Zwischenprodukts. Typischerweise verlaufen SN1-Reaktionen an sekundären oder tertiären Alkylhalogeniden oder an stabilisierten Systemen (z. B. benzylich, allylisch) in polaren, protischen Lösungsmitteln oder unter sauren Bedingungen; primäre Alkylhalogenide reagieren dagegen meist über die alternative SN2-Reaktion. Unter anorganischen Chemikern wird die SN1-Reaktion oft als dissoziativer Mechanismus bezeichnet. Christopher Ingold et al. schlugen den Reaktionsmechanismus erstmals 1940 vor.
Mechanismus (Schritt-für-Schritt)
- 1. Bildung des Carbokations (geschwindigkeitsbestimmender Schritt): Das Substrat R–LG (R = Alkylrest, LG = Abgangsgruppe) spaltet die Abgangsgruppe ab und bildet ein Carbokation R+ sowie das Anion LG−. Dieser Schritt ist energetisch am aufwendigsten und bestimmt die Reaktionsgeschwindigkeit.
- 2. Angriff des Nukleophils: Ein Nukleophil N: greift das elektrophile Carbokation an und bildet das Produkt R–N. Dieser Schritt verläuft meist schnell.
- 3. Gegebenenfalls Deprotonierung oder Solvolyse: Bei Solvensnukleophilen (z. B. H2O, ROH) kann zunächst ein protoniertes Zwischenprodukt entstehen, das dann deprotoniert wird.
Kinetik
SN1-Reaktionen folgen einer ersten Ordnung im Substrat: rate = k [R–LG]. Die Geschwindigkeit ist unabhängig von der Konzentration des Nukleophils, da dessen Angriff nicht der geschwindigkeitsbestimmende Schritt ist.
Faktoren, die die SN1-Reaktion begünstigen
- Substratstruktur: Stabilität des Carbokations ist entscheidend. Tertiäre Carbokationen >> sekundäre > primäre. Stabilisierende Effekte durch Benzylicität, Allylizität oder Resonanz erhöhen die Neigung zur SN1.
- Abgangsgruppe: Gute Abgangsgruppen (z. B. I−, Br−, Tosylat) erleichtern die Ionisation.
- Solvens: Polare, protische Lösungsmittel (z. B. H2O, Alkohole) stabilisieren Ionen und fördern SN1. Aprotic solvents begünstigen eher SN2.
- Nukleophilie: Für die Geschwindigkeitsbestimmung unerheblich, aber ein sehr schwaches Nukleophil (z. B. Lösungsmittel selbst) begünstigt oft den SN1-Weg.
- Temperatur/Polarität: Höhere Temperaturen und eine hohe Dielektrizitätskonstante des Lösungsmittels begünstigen die Ionisation.
Stereochemie und Ion-Paar-Effekte
Beim Angriff auf ein planar aufgebautes Carbokation erwartet man Racemisierung, wenn das stereogene Zentrum betroffen ist. In der Praxis beobachtet man oft nur teilweise Racemisierung, weil das Gegenion (LG−) oder Solventmoleküle eine ionische Paarung oder eine solvent-separated ion pair bilden können; dadurch kann ein teilweiser sterischer Schutz einer Seite des Carbokations verbleiben und zu einer gewissen Enantioselektivität führen.
Umlagerungen
Weil in SN1-Mechanismen Carbokationen als Zwischenstufen auftreten, sind Umlagerungen (Hydrid- oder Alkylverschiebungen) häufig. Solche Verschiebungen führen oft zu stabileren Carbokationen und damit zu unerwarteten Produkten, z. B. isomerisierten Alkoholen nach Hydrolyse.
Beispiele
- Hydrolyse von tert-Butylchlorid in Wasser: (CH3)3C–Cl → (CH3)3C+ + Cl− → (CH3)3C–OH (tert-Butanol).
- Solvolyse von benzylicen Halogeniden: Benzyliche Substrate reagieren besonders leicht über SN1, da das Benzylium-Kation durch Resonanz stabilisiert ist.
- Reaktionen von allylischen Halogeniden und von Substraten mit elektronenziehenden oder -donierenden Substituenten, die das Carbokation stabilisieren.
Vergleich SN1 vs. SN2 (kurz)
- SN1: Unimolekularer Geschwindigkeitsbestimmender Schritt, Carbokation-Zwischenstufe, bevorzugt tertiäre und resonanzstabilisierte Substrate, polare protische Lösungsmittel, mögliche Umlagerungen, Tendenz zur Racemisierung.
- SN2: Bimolekularer, konzertierter Übergangszustand mit nukleophilem Hintereingriff, bevorzugt primäre Substrate, weniger Umlagerungen, vollständige Inversion der Konfiguration.
Experimenteller Nachweis und Energieprofil
Experimentell lässt sich eine SN1-Reaktion durch erste Ordnung der Geschwindigkeitskonstante (Linearisierung: ln[c] gegen Zeit) nachweisen. Ein typisches Reaktionsenergiediagramm zeigt eine hohe Aktivierungsenergie für den Zerfall zum Carbokation (Übergangszustand 1), gefolgt von einem niedrigeren Aktivierungsenergiebalken für den Nukleophilangriff.
Praktische Hinweise
- Zur Förderung einer SN1-Reaktion wählt man polare, protische Lösungsmittel und versucht, eine gute Abgangsgruppe zu haben.
- Bei entgegengesetzten Beobachtungen (z. B. kein Racemisationsgrad, kein Umlagerungsprodukt) sollte geprüft werden, ob statt SN1 eine SN2-, E1- oder ein anderer Mechanismus vorliegt.
Insgesamt ist die SN1-Reaktion ein zentraler Mechanismus der organischen Chemie, wichtig zur Erklärung vieler Substitutionsprozesse, insbesondere wenn ionische Zwischenstufen und Umlagerungen eine Rolle spielen.
Mechanismus
Ein Beispiel für eine Reaktion, die mit einem SN1-Reaktionsmechanismus abläuft, ist die Hydrolyse von tert-Butylbromid mit Wasser unter Bildung von tert-Butylalkohol:
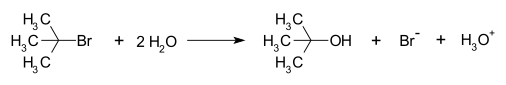
Diese SN1-Reaktion erfolgt in drei Schritten:
- Bildung eines tert.-Butylcarbocations durch Abtrennung einer Abgangsgruppe (eines Bromidanions) vom Kohlenstoffatom; dieser Schritt ist langsam und reversibel.
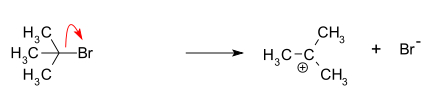
- Nukleophiler Angriff: das Carbokation reagiert mit dem Nukleophil. Wenn das Nucleophil ein neutrales Molekül (d.h. ein Lösungsmittel) ist, ist ein dritter Schritt erforderlich, um die Reaktion abzuschließen. Wenn das Lösungsmittel Wasser ist, ist das Zwischenprodukt ein Oxoniumion. Dieser Reaktionsschritt ist schnell.

- Deprotonierung: Entfernung eines Protons auf dem protonierten Nukleophil durch Wasser, das als Base den Alkohol und ein Hydroniumion bildet. Dieser Reaktionsschritt ist schnell.
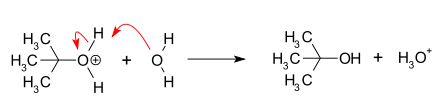
Da der erste Schritt der Engpass oder "ratenbestimmende Schritt" ist, klassifizieren Chemiker den gesamten Reaktionsmechanismus als SN1. Für diesen Schritt wird nur ein Molekül benötigt.
Umfang der Reaktion
Manchmal kann ein Molekül entweder mit einem SN1- oder einem SN2-Mechanismus reagieren. Der SN1-Mechanismus wird diesen Wettbewerb gewinnen, wenn das zentrale Kohlenstoffatom von sperrigen Gruppen umgeben ist, weil diese Gruppen die SN2-Reaktion sterisch behindern. Darüber hinaus erhöhen sperrige Substituenten am zentralen Kohlenstoffatom die Rate der Carbokationsbildung, da die auftretende sterische Belastung gemildert wird. Das resultierende Carbokation wird ebenfalls sowohl durch induktive Stabilisierung als auch durch Hyperkonjugation von angehängten Alkylgruppen stabilisiert. Das Hammond-Leffler-Postulat besagt, dass auch dies die Rate der Carbokokationsbildung erhöht. Der SN1-Mechanismus dominiert daher bei Reaktionen an tertiären Alkylzentren und wird weiterhin an sekundären Alkylzentren in Gegenwart von schwachen Nukleophilen beobachtet.
Ein Beispiel für eine SN1-artig ablaufende Reaktion ist die Synthese von 2,5-Dichlor-2,5-dimethylhexan aus dem entsprechenden Diol mit konzentrierter Salzsäure:
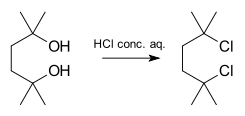
Wenn die Alpha- und Betasubstitutionen in Bezug auf die Abgangsgruppen zunehmen, wird die Reaktion von SN2 auf SN1 umgeleitet.
Stereochemie
Das Carbokation-Zwischenprodukt, das im Schritt der Geschwindigkeitsbegrenzung der Reaktion gebildet wird, ist ein sp2-hybridisierter Kohlenstoff mit trigonaler planarer Molekulargeometrie. Dies ermöglicht zwei verschiedene Wege für den nukleophilen Angriff, einen auf beiden Seiten des planaren Moleküls. Wenn keiner der beiden Pfade bevorzugt wird, werden diese beiden Pfade gleichwertig verwendet, so dass sich ein racemisches Gemisch von Enantiomeren ergibt, wenn die Reaktion in einem Stereocenter stattfindet. Dies wird unten in der SN1-Reaktion von S-3-Chlor-3-methylhexan mit einem Iodidion veranschaulicht, die ein racemisches Gemisch von 3-Iod-3-methylhexan ergibt:
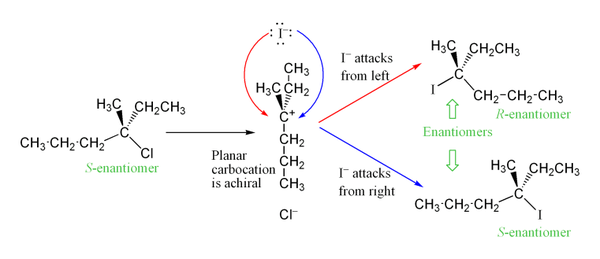
Es kann jedoch ein Überschuss von einem Stereoisomer beobachtet werden, da die austretende Gruppe für kurze Zeit in der Nähe des Carbokations-Zwischenprodukts bleiben und den nukleophilen Angriff blockieren kann. Dies ist ganz anders als der SN2-Mechanismus, der die Stereochemie des Produkts nicht vermischt (ein stereospezifischer Mechanismus). Der SN2-Mechanismus kehrt immer die Stereochemie des Moleküls um.
Nebenreaktionen
Zwei häufige Nebenreaktionen sind Eliminationsreaktionen und Carbokationsumlagerung. Wenn die Reaktion unter warmen oder heißen Bedingungen durchgeführt wird (die eine Erhöhung der Entropie begünstigen), überwiegt wahrscheinlich die E1-Eliminierung, was zur Bildung eines Alkens führt. Bei niedrigeren Temperaturen sind SN1- und E1-Reaktionen kompetitive Reaktionen. Daher wird es schwierig, die eine der beiden Reaktionen gegenüber der anderen zu bevorzugen. Selbst wenn die Reaktion kalt durchgeführt wird, kann es zur Bildung eines Alkens kommen. Wenn versucht wird, eine SN1-Reaktion mit einem stark basischen Nukleophil wie Hydroxid- oder Methoxidionen durchzuführen, wird das Alken erneut gebildet, diesmal durch eine E2-Eliminierung. Dies gilt insbesondere dann, wenn die Reaktion erhitzt wird. Wenn sich das Carbokation-Zwischenprodukt schließlich zu einem stabileren Carbokation umlagern kann, wird es ein Produkt ergeben, das von dem stabileren Carbokation und nicht von dem einfachen Substitutionsprodukt abgeleitet ist.
Lösungsmittelwirkungen
Lösungsmittel verändern die Reaktionsgeschwindigkeit. Da die SN1-Reaktion die Bildung eines instabilen Carbokation-Zwischenprodukts im Schritt der Geschwindigkeitsbestimmung beinhaltet, wird alles, was dazu beitragen kann, die Reaktion beschleunigen. Die normalen Lösungsmittel der Wahl sind sowohl polar (zur Stabilisierung ionischer Zwischenprodukte im Allgemeinen) als auch protisch (zur Solvatisierung der Abgangsgruppe im Besonderen). Zu den typischen polaren protischen Lösungsmitteln gehören Wasser und Alkohole, die auch als Nukleophile wirken.
Die Y-Skala korreliert die Solvolysereaktionsraten eines beliebigen Lösungsmittels (k) mit denen eines Standardlösungsmittels (80% v/v Ethanol/Wasser) (k0) durch
log ( k k 0 ) = m Y {\darstellungsstil \log {\links({\frac {k}{k_{0}}}}\rechts)}=mY\,}
mit m einer Reaktantenkonstante (m = 1 für tert.-Butylchlorid),
- Y ein Lösungsmittel-Parameter, und
- k0 ist die Reaktionsgeschwindigkeit bei Verwendung eines Lösungsmittels aus 80% Ethanol (gemessen nach Volumen).
Zum Beispiel ergibt 100% Ethanol Y = -2,3, 50% Ethanol in Wasser Y = +1,65 und 15% Konzentration Y = +3,2.
Fragen und Antworten
F: Wofür steht "SN" in SN1-Reaktion?
A: "SN" steht für nukleophile Substitution.
F: Was bedeutet "1" in der SN1-Reaktion?
A: "1" steht für die Tatsache, dass an dem geschwindigkeitsbestimmenden Schritt nur ein Molekül beteiligt ist (unimolekular).
F: Welche Art von Reaktion ist SN1?
A: SN1 ist eine Substitutionsreaktion.
F: Welches Zwischenprodukt ist an der SN1-Reaktion beteiligt?
A: An der SN1-Reaktion ist ein Carbokation-Zwischenprodukt beteiligt.
Q: Unter welchen Bedingungen finden übliche SN1-Reaktionen statt?
A: Übliche SN1-Reaktionen finden mit sekundären oder tertiären Alkylhalogeniden unter stark basischen Bedingungen oder mit sekundären oder tertiären Alkoholen unter stark sauren Bedingungen statt.
F: Welche alternative Reaktion tritt bei primären Alkylhalogeniden auf?
A: Mit primären Alkylhalogeniden findet die alternative SN2-Reaktion statt.
F: Wer hat den SN1-Reaktionsmechanismus zuerst vorgeschlagen und in welchem Jahr?
A: Christopher Ingold et al. schlugen den SN1-Reaktionsmechanismus erstmals 1940 vor.
Suche in der Enzyklopädie
