Liste der Atommodelle
In Chemie und Physik erklärt die Atomtheorie, wie sich unser Verständnis des Atoms im Laufe der Zeit verändert hat. Atome wurden einst für die kleinsten Teilchen der Materie gehalten. Heute weiß man jedoch, dass Atome aus Protonen, Neutronen und Elektronen bestehen. Diese subatomaren Teilchen setzen sich aus Quarks zusammen. Die erste Idee des Atoms stammt von dem griechischen Philosophen Demokrit. Viele der Ideen in der modernen Theorie stammen von John Dalton, einem britischen Chemiker und Physiker.
Die Theorie gilt für Festkörper, Flüssigkeiten und Gase, aber sie gilt nicht in analoger Weise für Plasmen oder Neutronensterne.

John Dalton (1766-1844), englischer Chemiker und Physiker
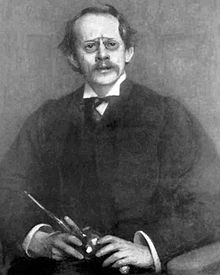
Sir Joseph John Thomson (1856-1940), englischer Physiker, entdeckte das Elektron und seine negative Ladung. Er erhielt den Nobelpreis für Physik.

Demokrit war ein griechischer Philosoph, 460 v. Chr.

Roger Joseph Boscovich. Ein kroatischer Jesuit, der einen Prototyp der Atomtheorie lieferte
Demokrits' Atomtheorie
Demokrit dachte, wenn man etwas immer wieder halbiert, müsse man endlich aufhören. Er sagte, dass dieses letzte Stück Materie nicht kleiner geschnitten werden könne. Demokrit nannte diese kleinen Materiestücke Atome, was "unteilbar" bedeutet. Er dachte, dass Atome ewig halten, sich nie verändern und nicht zerstört werden können. Demokrit dachte, dass es nichts zwischen den Atomen gibt und dass alles um uns herum erklärt werden könnte, wenn wir verstehen würden, wie Atome funktionieren.
Einige andere Philosophen stimmten dem zu, andere wiederum waren anderer Meinung. Sie hatten keine Möglichkeit zu experimentieren, um zu zeigen, ob seine Theorie wahr ist oder nicht.
Boscovitschs Atomtheorie
1758 beschrieb Roger Joseph Boscovich einen Vorläufer der Atomtheorie.
Daltons Atomtheorie
1803 überarbeitete der englische Wissenschaftler John Dalton, geboren in Cumberland, die Theorie von Demokrit wie folgt:
- Alle Materie wird aus Atomen gebildet.
- Dass Atome unteilbare und unsichtbare Teilchen sind.
- Dass Atome des gleichen Elements vom gleichen Typ und der gleichen Masse sind.
- Die Atome, aus denen chemische Verbindungen bestehen, sind in festgelegten Anteilen vorhanden.
- Chemische Veränderungen entsprechen einer Reorganisation der an der chemischen Reaktion beteiligten Atome.
Dalton definierte das Atom als die Grundeinheit eines Elements, das an einer chemischen Kombination teilnehmen kann.
Thomson'sches Atommodell
Im Jahr 1850 konstruierte Sir William Crookes eine "Entladungsröhre", d.h. eine Glasröhre, bei der die Luft entfernt wird und an deren Enden metallische Elektroden an eine Hochspannungsquelle angeschlossen sind. Beim Erzeugen eines Vakuums in der Röhre ist eine Lichtentladung zu sehen, die von der Kathode (negativ geladene Elektrode) zur Anode (positiv geladene Elektrode) verläuft. Crookes nannten die Emission "Kathodenstrahlen".
Nach den Kathodenstrahl-Experimenten stellte Sir Joseph John Thomson fest, dass der emittierte Strahl durch negative Ladungen gebildet wurde, weil sie vom positiven Pol angezogen wurden. Thomson wusste, dass die Atome elektrisch neutral waren, aber er stellte fest, dass ein Atom die gleiche Menge negativer und positiver Ladungen haben musste, damit dies geschehen konnte. Die negativen Ladungen wurden Elektronen (e-) genannt.
Entsprechend den über die neutrale Ladung der Atome aufgestellten Annahmen schlug Thomson das erste Atommodell vor, das als positiv geladene Kugel beschrieben wurde, in die die Elektronen (mit negativen Ladungen) eingelagert waren. Es ist als das Pflaumenpuddingmodell bekannt.
Im Jahr 1906 stellte Robert Millikan fest, dass die Elektronen eine Coulomb (C)-Ladung von -1,6 * 10-19 hatten, was die Berechnung ihrer Masse als winzig klein, gleich 9,109 * 10-31 kg, erlaubte.
Gleichzeitig konnte Eugene Goldstein 1886 durch Experimente mit Kathodenentladungsröhren feststellen, dass die positiven Ladungen eine Masse von 1,6726 * 10-27 kg und eine elektrische Ladung von +1,6 * 10 -19 C hatten. Lord Ernest Rutherford nannte diese positiv geladenen Teilchen später Protonen

Schematische Darstellung des Thomson-Modells.
Rutherfords Atommodell
1910 stellte der neuseeländische Physiker Ernest Rutherford die Idee vor, dass sich die positiven Ladungen des Atoms hauptsächlich in seinem Zentrum, im Kern, und den Elektronen (e-) um ihn herum befinden.
Rutherford zeigte dies, als er eine Alpha-Strahlungsquelle (aus Helium) verwendete, um die sehr dünnen Goldbleche zu treffen, die von einem Zinksulfid-Lampenschirm umgeben waren, der sichtbares Licht erzeugte, wenn er von Alpha-Emissionen getroffen wurde. Dieses Experiment wurde das Geiger-Marsden-Experiment oder das Goldfolien-Experiment genannt.
Zu diesem Zeitpunkt waren die Hauptelemente des Atoms klar, sowie die Entdeckung, dass die Atome eines Elements in Isotopen vorkommen können. Isotope variieren in der Anzahl der im Kern vorhandenen Neutronen. Obwohl dieses Modell gut verstanden wurde, hat sich die moderne Physik weiter entwickelt, und die heutigen Vorstellungen können nicht leicht verständlich gemacht werden. Eine Vorstellung von der heutigen Atomphysik finden Sie unter den Links in der Tabelle unten.
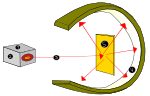
Atomversuch von Lord Ernest Rutherford
Moderne Physik
Atome sind keine Elementarteilchen, da sie aus subatomaren Teilchen wie Protonen und Neutronen bestehen. Auch Protonen und Neutronen sind keine Elementarteilchen, weil sie aus noch kleineren Teilchen, den sogenannten Quarks, bestehen, die durch andere Teilchen, die Gluonen genannt werden, miteinander verbunden sind (weil sie die Quarks im Atom "zusammenkleben"). Quarks sind elementar, weil Quarks nicht weiter zerlegt werden können.
Fragen und Antworten
F: Was ist die Atomtheorie?
A: Die Atomtheorie erklärt, wie sich unser Verständnis des Atoms im Laufe der Zeit verändert hat.
F: Wofür wurden Atome früher gehalten?
A: Früher dachte man, Atome seien die kleinsten Teile der Materie.
F: Woraus bestehen Atome eigentlich?
A: Atome bestehen aus Protonen, Neutronen und Elektronen.
F: Woraus bestehen subatomare Teilchen?
A: Subatomare Teilchen bestehen aus Quarks.
F: Wer ist der griechische Philosoph, der als erster die Idee des Atoms entwickelt hat?
A: Die erste Idee des Atoms stammt von dem griechischen Philosophen Demokrit.
F: Wer ist der britische Chemiker und Physiker, der viele Ideen zur modernen Theorie beigetragen hat?
A: John Dalton, ein britischer Chemiker und Physiker, trug viele Ideen zur modernen Theorie bei.
F: Gilt die Atomtheorie auch für Plasmen oder Neutronensterne?
A: Die Theorie gilt für feste, flüssige und gasförmige Stoffe, aber nicht analog für Plasmen oder Neutronensterne.
Suche in der Enzyklopädie