Batterie: Definition, Funktionsweise, Arten & Anwendungen
Batterie: Definition, Funktionsweise, Arten & Anwendungen – Unterschiede von Primär‑ vs. Sekundärbatterien, Einsatzbereiche von Mobilgeräten bis Elektroautos, praxisnah und verständlich erklärt.
Eine Batterie wandelt chemische Energie durch eine chemische Reaktion in elektrische Energie um. Normalerweise werden die Chemikalien im Inneren der Batterie in getrennten Bereichen (Elektroden und Elektrolyt) aufbewahrt. Sie wird in einem Schaltkreis verwendet, um andere Komponenten mit Strom zu versorgen. Eine Batterie erzeugt Gleichstrom (DC) — Elektrizität, die in eine Richtung fließt und nicht hin- und her geschaltet wird.
Wozu Batterien nützlich sind
Die Nutzung des Stroms aus einer Steckdose in einem Gebäude ist oft günstiger und effizienter, aber eine Batterie kann Strom in Gebieten liefern, in denen es keine Stromverteilung gibt. Sie ist auch unverzichtbar für mobile Anwendungen wie Elektrofahrzeuge und Mobiltelefone, für Notstromversorgungen, tragbare Geräte und für Energiespeicher in Kombination mit erneuerbaren Energien.
Funktionsweise (vereinfacht)
Im Inneren einer Batterie laufen chemische Reaktionen an zwei Polen ab: der Anode (Minuspol) und der Kathode (Pluspol). Beim Entladen geben Atome an der Anode Elektronen ab, die über den äußeren Stromkreis zur Kathode fließen. Gleichzeitig bewegen sich geladene Teilchen (Ionen) durch den Elektrolyten innerhalb der Batterie, um die Ladungsbilanz auszugleichen. Beim Laden (nur bei wiederaufladbaren Batterien) wird dieser Prozess durch Zuführung elektrischer Energie umgekehrt.
Wichtige Kenngrößen
- Nennspannung: typische Zellspannungen sind z. B. 1,5 V (Alkaline), 1,2 V (NiMH/NiCd), ~3,6–3,7 V (Lithium-Ionen), 2,0 V pro Zelle (Blei-Säure).
- Kapazität: angegeben in Amperestunden (Ah) oder Milliamperestunden (mAh) – gibt an, wie viel Ladung die Batterie liefern kann.
- Energie: in Wattstunden (Wh) = Spannung × Kapazität.
- Leistung: wie schnell Energie entnommen werden kann (Ausgangsstrom); wichtig bei Motoranwendungen.
- Innenwiderstand: beeinflusst Spannungsabfall unter Last und Wärmeentwicklung.
- Selbstentladung: Verlust von Ladung im Laufe der Zeit, auch ohne Verbrauch.
- Zyklenfestigkeit: Anzahl von Lade-/Entladezyklen, die eine wiederaufladbare Batterie sinnvoll durchhält.
Arten von Batterien
Batterien lassen sich grob in zwei Gruppen einteilen:
- Primärbatterien (einmalig verwendbar): Diese werden weggeworfen, wenn sie entladen sind. Typische Beispiele: Zink-Kohle, Alkaline, einige Lithium-Metall-Zellen. Sie haben oft eine hohe Energiedichte pro Kosten und eine geringe Selbstentladung.
- Sekundärbatterien (wiederaufladbar): Diese können wieder aufgeladen und wiederverwendet werden. Wichtige Typen sind:
- Blei-Säure: altbewährt für Starterbatterien in Fahrzeugen und für USV-Systeme; robust und kostengünstig, aber geringere Energiedichte und schwer.
- Nickel-Cadmium (NiCd): langlebig und belastbar, aber giftiges Cadmium — heute weniger verbreitet.
- Nickel-Metallhydrid (NiMH): ersetzt oft NiCd in Haushaltsgrößen (AA, AAA), bessere Energie pro Volumen als NiCd.
- Lithium-Ionen (Li‑Ion): hohe Energiedichte, weit verbreitet in Smartphones, Laptops und Elektrofahrzeugen; sensibel gegenüber Überladung und thermischer Belastung.
Anordnung von Zellen
Um höhere Spannungen oder größere Kapazitäten zu erreichen, werden Zellen in Serie (Spannung addiert) oder parallel (Kapazität addiert) geschaltet. Bei Batteriepacks sind BMS (Battery Management System) üblich, um Ladezustand, Temperatur und Zellbalancing zu überwachen.
Anwendungen
- Tragbare Elektronik (Handys, Laptops, Kameras)
- Mobilität (elektrische Autos, E-Bikes, Scooter)
- Stationäre Energiespeicher (Heimspeicher für Solarenergie, Netzstabilisierung)
- Notstromversorgung (USV, Rettungsgeräte)
- Spielzeug, Fernbedienungen, Werkzeuge (Akkuschrauber)
Sicherheit und Handhabung
Batterien können bei unsachgemäßer Verwendung gefährlich sein: Kurzschlüsse, starke Hitze, Beschädigung oder falsches Laden (insbesondere bei Lithium-Zellen) können zu Überhitzung, Brand oder Explosionsgefahr (thermal runaway) führen. Wichtige Regeln:
- Nur vom Hersteller empfohlene Ladegeräte verwenden.
- Batterien nicht mechanisch beschädigen oder in Wasser werfen.
- Vor extremen Temperaturen schützen (sehr heiß oder sehr kalt reduziert Lebensdauer).
- Bei Leckage oder ungewöhnlicher Erwärmung Batterie nicht weiter verwenden und fachgerecht entsorgen.
Umwelt und Entsorgung
Viele Batterien enthalten umweltrelevante Stoffe (Schwermetalle, Elektrolyte). Daher sind sachgerechte Sammlung und Recycling wichtig. Wiederaufladbare Batterien reduzieren Abfall gegenüber Einweg-Batterien, benötigen aber ebenfalls Recycling. Lokale Sammelstellen oder kommunale Recyclingprogramme nehmen Altbatterien entgegen.
Zusammenfassung
Batterien sind chemische Energiespeicher, die durch chemische Reaktionen elektrischen Strom liefern. Sie sind in primäre (nicht wiederaufladbar) und sekundäre (wiederaufladbar) Typen unterteilt und kommen in zahlreichen Bauformen und Chemien vor. Wichtige Eigenschaften sind Spannung, Kapazität, Energie- und Leistungsdichte sowie Lebensdauer. Sicherheit, richtiges Laden und umweltgerechte Entsorgung sind entscheidend für den sicheren und nachhaltigen Einsatz.
Schematisches Symbol einer Batterie

Die Chemie in einer Batterie
Eine Batterie kann aus einer Zelle oder aus mehreren Zellen bestehen. Jede Zelle hat eine Anode, eine Kathode und einen Elektrolyten. Der Elektrolyt ist das Hauptmaterial im Inneren der Batterie. Häufig handelt es sich dabei um eine Art Säure, die bei Berührung gefährlich sein kann. Die Anode reagiert mit dem Elektrolyten, um Elektronen zu erzeugen (dies ist das negative oder - Ende). Die Kathode reagiert mit dem Elektrolyten und nimmt Elektronen auf (dies ist das positive oder +-Ende). Ein elektrischer Strom entsteht, wenn ein Draht die Anode mit der Kathode verbindet und die Elektronen sich von einem Ende zum anderen bewegen. (Eine Batterie kann jedoch schon durch einen Draht, der die beiden Enden verbindet, beschädigt werden, so dass auch eine Last zwischen den beiden Enden erforderlich ist. Die Last ist etwas, das die Elektronen verlangsamt und normalerweise etwas Nützliches bewirkt, wie eine Glühbirne in einer Taschenlampe oder die Elektronik in einem Taschenrechner).Der Elektrolyt kann flüssig oder fest sein. Eine Batterie wird je nach Art des Elektrolyten als Nass- oder Trockenzellenbatterie bezeichnet.
Die chemischen Reaktionen, die in einer Batterie ablaufen, sind exotherme Reaktionen. Bei dieser Art von Reaktion entsteht Wärme. Wenn Sie beispielsweise Ihren Laptop längere Zeit eingeschaltet lassen und dann den Akku berühren, wird er warm oder heiß.
Eine wiederaufladbare Batterie wird durch Umkehrung der chemischen Reaktion, die innerhalb der Batterie stattfindet, wieder aufgeladen. Eine wiederaufladbare Batterie kann jedoch nur eine bestimmte Anzahl von Malen aufgeladen werden (Wiederaufladungslebensdauer). Selbst eingebaute Batterien können nicht ewig wieder aufgeladen werden. Darüber hinaus nimmt mit jedem Aufladen einer Batterie ihre Fähigkeit, eine Ladung zu halten, ein wenig ab. Nicht wiederaufladbare Batterien sollten nicht aufgeladen werden, da verschiedene schädliche Substanzen wie Kaliumhydroxid austreten können.
Die Zellen können verbunden werden, um eine größere Batterie zu erhalten. Das Verbinden des Positivs einer Zelle mit dem Negativ der nächsten Zelle nennt man Reihenschaltung. Die Spannungen der einzelnen Batterien werden addiert. Zwei in Reihe geschaltete Sechs-Volt-Batterien ergeben 12 Volt.
Das Verbinden des Positivs einer Zelle mit dem Positiv der anderen Zelle und des Negativs mit dem Negativ nennt man Parallelschaltung. Die Spannung bleibt gleich, aber der Strom wird addiert. Die Spannung ist der Druck, der die Elektronen durch die Drähte drückt, sie wird in Volt gemessen. Strom ist die Anzahl der Elektronen, die auf einmal fließen können, gemessen in Ampere. Die Kombination von Strom und Spannung ist die Leistung (Watt = Volt x Ampere) der Batterie.
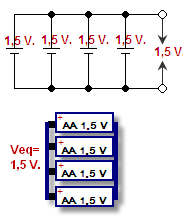
Parallel geschaltete Batterien - dargestellt in einem Schema und einer Zeichnung
Batterie-Größen
Batterien gibt es in vielen verschiedenen Formen, Größen und Spannungen.AA-, AAA-, C- und D-Zellen, einschließlich Alkalibatterien, sind von Standardgrößen und -formen und haben etwa 1,5 Volt. Die Spannung einer Zelle hängt von den verwendeten Chemikalien ab. Die elektrische Ladung, die sie liefern kann, hängt davon ab, wie groß die Zelle ist, sowie von den verwendeten Chemikalien. Die Ladung, die eine Batterie liefert, wird normalerweise in Amperestunden gemessen. Da die Spannung gleich bleibt, bedeutet mehr Ladung, dass eine grössere Zelle mehr Ampere liefern oder länger laufen kann.
Geschichte
Die erste Batterie wurde 1800 von Alessandro Volta erfunden. Heute nennt man seine Batterie den Voltastapel.In kleinen, modernen Batterien wird die Flüssigkeit in einer Art Paste immobilisiert und alles in ein versiegeltes Gehäuse gegeben. Aufgrund dieses Gehäuses kann nichts aus der Batterie austreten. Größere Batterien, wie Autobatterien, haben immer noch Flüssigkeit im Inneren und sind nicht versiegelt. Eine Art Batterie, die geschmolzene Salze als Elektrolyt verwendet, wurde während des Zweiten Weltkriegs erfunden.
Arten von Batterien
- Trockenzellen, Zellen, die keine Flüssigkeit (oder eine immobilisierte Flüssigkeit wie eine Paste oder ein Gel) als Elektrolyt enthalten
- Primärzelle, Zellen, die nicht wieder aufgeladen werden können
- Alkaline-Batterie, "alkalisch", nicht wiederaufladbar
- Quecksilberbatterie, nicht wiederaufladbar
- Leclanche-Batterie, "super heavy duty", nicht wiederaufladbar
- Lithium-Batterie, nicht wiederaufladbar, "Knopfzelle".
- Silberoxid-Batterie, nicht wiederaufladbar, Uhrenbatterie
- Voltaischer Pfahl, Allesandro Voltas erste Batterie
- Sekundärzelle, Zellen, die wieder aufgeladen werden können
- Verschlossene Blei-Säure-Batterie
- Lithium-Ionen-Akku, wiederaufladbar, verwendet in Mobiltelefonen und Laptops
- Nickel-Kadmium-Batterie, "NiCd", wiederaufladbar
- Nickel-Metallhydrid-Batterie, "NiMH", wiederaufladbar
- Nickel-Zink-Batterie
- Nasszellen, Zellen, die Flüssigkeit als Elektrolyt enthalten
- Blei-Säure-Batterie, wiederaufladbar, Autobatterie
- Nickel-Eisen-Batterie, wiederaufladbar, Edison-Batterie
- Brennstoffzelle, aufgeladen durch Zugabe von Brennstoff

Draufsicht auf die Autobatterie
Alternativen zu Batterien
Brennstoffzellen und Solarzellen sind keine Batterien, weil sie die Energie in ihrem Inneren nicht speichern.Ein Kondensator ist keine Batterie, da er die Energie nicht in einer chemischen Reaktion speichert. Ein Kondensator kann Elektrizität speichern und viel schneller Strom erzeugen als eine Batterie, aber es kostet normalerweise zu viel, ihn so groß zu machen, wie eine Batterie sein kann. Wissenschaftler und Chemieingenieure arbeiten daran, bessere Kondensatoren und Batterien für Elektroautos herzustellen.
Kleine elektrische Generatoren, die von Hand und Fuß betrieben werden, können Strom in kleinen elektrischen Geräten liefern. Uhrwerkradios, Uhrwerkfackeln und ähnliche Geräte haben auch eine Aufziehfeder zur Speicherung mechanischer Energie.
Fragen und Antworten
F: Was ist eine Batterie?
A: Eine Batterie ist ein Gerät, das chemische Energie durch eine chemische Reaktion in elektrische Energie umwandelt.
F: Wie erzeugt eine Batterie Strom?
A: Eine Batterie erzeugt Gleichstrom (DC), der in eine Richtung fließt und nicht hin und her wechselt.
F: Wo werden die Chemikalien in einer Batterie aufbewahrt?
A: Normalerweise befinden sich die Chemikalien im Inneren der Batterie.
F: Was ist der Unterschied zwischen einer Primär- und einer Sekundärbatterie?
A: Eine Primärbatterie wird weggeworfen, wenn sie keinen Strom mehr liefern kann, während eine Sekundärbatterie wieder aufgeladen und wiederverwendet werden kann.
F: Warum sind Batterien nützlich?
A: Batterien sind nützlich für die Stromversorgung in Gebieten, in denen es kein Stromnetz gibt, und für Dinge, die sich bewegen, wie Elektrofahrzeuge und Mobiltelefone.
F: Ist die Nutzung von Strom aus der Steckdose in einem Gebäude billiger und effizienter als die Nutzung einer Batterie?
A: Ja, die Verwendung von Strom aus der Steckdose ist billiger und effizienter als die Verwendung einer Batterie.
F: Welche Art von Strom erzeugt eine Batterie?
A: Eine Batterie erzeugt Gleichstrom (DC).
Suche in der Enzyklopädie