Molekulares Orbital
In der Chemie erklärt ein molekulares Orbital (oder MO), was mit den Elektronen geschieht, wenn sich Atome zu einem Molekül zusammenschließen. Eine MO ist eine mathematische Funktion, die das wellenartige Verhalten eines Elektrons in einem Molekül beschreibt. Chemiker verwenden solche Funktionen, um chemische und physikalische Eigenschaften vorherzusagen oder zu erklären. Die Funktionen können zum Beispiel die Wahrscheinlichkeit angeben, mit der ein Elektron in einem bestimmten Bereich gefunden wird.
Chemiker bauen in der Regel mathematische Modelle von Molekülorbitalen, indem sie Atomorbitale kombinieren. Es können auch Hybridorbitale aus jedem Atom des Moleküls oder andere Molekülorbitale aus Gruppen von Atomen verwendet werden. Computer können mit diesen Funktionen arbeiten. Molekülorbitale ermöglichen Chemikern die Anwendung der Quantenmechanik zur Untersuchung von Molekülen. MOs beantworten Fragen darüber, wie die Atome in Molekülen aneinander haften. Die verschiedenen abgerundeten Formen in einem Orbitaldiagramm zeigen an, wo die Elektronen in einem Atom am wahrscheinlichsten zu finden wären.
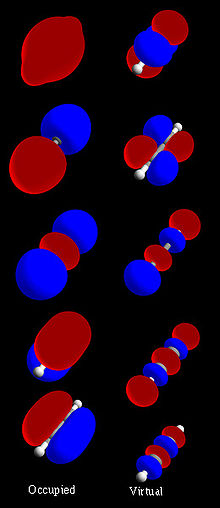
Abbildung 1: Vollständiger molekularer Acetylen (H-C≡C-H) Orbitalsatz
Geschichte
Das Wort orbital wurde erstmals von Robert S. Mulliken im Englischen verwendet. Der deutsche Physiker Erwin Schrödinger hat bereits früher über MOs geschrieben. Schrödinger nannte sie Eigenfunktion.
Der Physiker Max Born beschrieb 1926 die Theorie der molekularen Orbitale. Heute ist sie als Born'sche Regel bekannt und ist Teil der Kopenhagener Interpretation der Quantenmechanik. Als diese Theorie ursprünglich vorgeschlagen wurde, stimmte sie nicht mit dem Atommodell von Niels Bohr überein. Das Bohr'sche Modell beschrieb die Elektronen als den Kern "umkreisend", da sie sich im Kreis bewegten. Das Modell von Born fand jedoch schließlich populäre Unterstützung, weil es die Orte der Elektronen innerhalb von Molekülen beschreiben und eine Reihe von bisher unerklärlichen chemischen Reaktionen erklären konnte.
Übersicht
Atomorbitale sagen die Position eines Elektrons in einem Atom voraus. Molekulare Orbitale entstehen, wenn Atomorbitale zusammengebracht werden. Ein Molekülorbitale kann Informationen über die Elektronenkonfiguration eines Moleküls geben. Die Elektronenkonfiguration ist die wahrscheinlichste Position und die Energie eines (oder eines Paares von) Elektron(en). Meistens wird eine MO als eine lineare Kombination von Atomorbitalen dargestellt (die LCAO-MO-Methode), insbesondere bei näherungsweiser Verwendung. Das bedeutet, dass Chemiker davon ausgehen, dass die Wahrscheinlichkeit, dass sich ein Elektron an einem beliebigen Punkt im Molekül befindet, die Summe der Wahrscheinlichkeiten ist, dass sich das Elektron aufgrund der einzelnen Atomorbitale dort befindet. LCAO-MO ist ein einfaches Modell der Bindung in Molekülen und ist wichtig für das Studium der molekularen Orbitaltheorie.
Theoretische Chemiker verwenden Computer, um die MOs verschiedener Moleküle (sowohl realer als auch imaginärer Art) zu berechnen. Der Computer kann Diagramme der "Wolke" zeichnen, um zu zeigen, wie wahrscheinlich das Elektron in jeder Region sein wird. Die Computer können auch Informationen über die physikalischen Eigenschaften des Moleküls geben. Sie können auch sagen, wie viel Energie benötigt wird, um das Molekül zu bilden. Dies hilft den Chemikern zu sagen, ob einige kleine Moleküle zu größeren Molekülen kombiniert werden können.
Die meisten heutigen Methoden der computergestützten Chemie beginnen mit der Berechnung der MOs eines Systems. Das elektrische Feld jeder MO wird von den Kernen aller Atome und einer gewissen durchschnittlichen Verteilung der anderen Elektronen erzeugt.
Analogie
MOs zu verstehen ist wie die Aufgabe zu wissen, wo sich jeder Mitarbeiter in einem großen Baumarkt befindet (ohne in den Laden hineinzuschauen). Ein Analytiker kennt die Anzahl der im Geschäft tätigen Mitarbeiter und die Abteilung jedes Mitarbeiters. Er weiß auch, dass sich die Mitarbeiter nicht auf die Füße treten und dass die Mitarbeiter im Gang und nicht in den Warenregalen stehen. Die Mitarbeiter verlassen ihre eigene Abteilung, um Kunden bei der Suche nach Waren in anderen Abteilungen oder bei der Bestandsaufnahme zu helfen. Ein Analytiker, der den Standort aller Mitarbeiter im Laden zu einem ausgewählten Zeitpunkt angibt, ohne hineinzuschauen, ist wie ein Chemiker, der die MOs eines Moleküls berechnet. So wie die MOs nicht den genauen Standort jedes Elektrons angeben können, ist der genaue Standort jedes Mitarbeiters nicht bekannt. Eine MO mit einer Knotenebene ist wie die Schlussfolgerung, dass Mitarbeiter durch Gänge gehen und nicht durch Regale. Obwohl Elektronen von einem bestimmten Atom beigesteuert werden, füllt das Elektron eine MO ohne Rücksicht auf das Quellatom. Das ist so, als ob ein Mitarbeiter seine Abteilung verlässt, um tagsüber an einem anderen Ort im Geschäft zu gehen. Eine MO ist also eine unvollständige Beschreibung eines Elektrons, so wie die Berechnungen des Analytikers über das ungesehene Geschäft eine unvollständige Vermutung über die Standorte der Mitarbeiter ist.

Die Berechnung der MOs ist wie die Vorhersage des Standortes jedes Mitarbeiters in einem Baumarkt.
Bildung von Molekülorbitalen
Theoretische Chemiker haben Regeln für die Berechnung von MOs erfunden. Diese Regeln stammen aus dem Verständnis der Quantenmechanik. Die Quantenmechanik hilft den Chemikern, anhand dessen, was die Physik über die Elektronen gesagt hat, herauszufinden, wie sich die Elektronen in Molekülen verhalten. Molekülorbitale bilden sich aus "erlaubten" Wechselwirkungen zwischen Atomorbitalen. (Die Wechselwirkungen sind "erlaubt", wenn die (aus der Gruppentheorie bestimmten) Symmetrien der Atomorbitale miteinander kompatibel sind). Chemiker studieren atomare Orbitalwechselwirkungen. Diese Wechselwirkungen entstehen durch die Überlappung (ein Maß dafür, wie gut zwei Orbitale konstruktiv miteinander wechselwirken) zwischen zwei Atomorbitalen. Die Überlappung ist wichtig, wenn die Atomorbitale energetisch nahe beieinander liegen. Schließlich muss die Anzahl der MOs in einem Molekül gleich der Anzahl der Atomorbitale in den Atomen sein, die zur Bildung des Moleküls zusammengebracht werden.
Qualitativer Ansatz
Chemiker müssen die Geometrie der MOs verstehen, um die molekulare Struktur diskutieren zu können. Die LCMO-Methode (Linear combination of atomic orbitals molecular orbital) gibt eine grobe, aber gute Beschreibung der MOs. Bei dieser Methode werden die Molekülorbitale als Linearkombinationen aller Atomorbitale jedes Atoms im Molekül ausgedrückt.
Linearkombinationen von Atomorbitalen (LCAO)
Molekulare Orbitale wurden erstmals von Friedrich Hund und Robert S. Mulliken in den Jahren 1927 und 1928 eingeführt.
Die lineare Kombination von Atomorbitalen oder "LCAO"-Näherung für Molekülorbitale wurde 1929 von Sir John Lennard-Jones eingeführt. Seine bahnbrechende Arbeit zeigte, wie man die elektronische Struktur der Fluor- und Sauerstoffmoleküle aus Quantenprinzipien ableiten kann. Diese qualitative Annäherung an die molekulare Orbital-Theorie ist Teil des Beginns der modernen Quantenchemie.
Linearkombinationen von Atomorbitalen (LCAO) können verwendet werden, um die Molekülorbitale zu erraten, die entstehen, wenn die Atome des Moleküls miteinander verbunden werden. Ähnlich wie bei einem Atomorbit kann auch für ein Molekülorbit eine Schrödingergleichung, die das Verhalten eines Elektrons beschreibt, konstruiert werden. Linearkombinationen von Atomorbitalen (die Summen und Differenzen der atomaren Wellenfunktionen) liefern ungefähre Lösungen für die molekularen Schrödinger-Gleichungen. Für einfache zweiatomige Moleküle werden die Wellenfunktionen, die Sie erhalten, mathematisch durch die Gleichungen
Ψ = caψa + cbψb
und
Ψ* = caψa - cbψb
wobei Ψ und Ψ* die molekularen Wellenfunktionen für die bindenden bzw. antikörperbindenden Molekülorbitale sind, ψa und ψb die atomaren Wellenfunktionen von den Atomen a bzw. b sind und ca und cb einstellbare Koeffizienten sind. Diese Koeffizienten können positiv oder negativ sein, abhängig von den Energien und Symmetrien der einzelnen Atomorbitale. Wenn sich die beiden Atome einander annähern, überlappen sich ihre Atomorbitale, um Bereiche mit hoher Elektronendichte zu erzeugen. So bilden sich zwischen den beiden Atomen Molekülorbitale. Die Atome werden durch die elektrostatische Anziehung zwischen den positiv geladenen Kernen und den negativ geladenen Elektronen zusammengehalten, die bindende Molekülorbitale besetzen.
Bonding, Antibonding und Nonbonding MOs
Wenn Atomorbitale interagieren, kann das resultierende Molekülorbit von drei Typen sein: bindend, antibindend oder nicht bindend.
Bonding MOs:
- Bindungswechselwirkungen zwischen Atomorbitalen sind konstruktive (phasengleiche) Wechselwirkungen.
- Bindungs-MOs haben eine niedrigere Energie als die Atomorbitale, die sich zu ihrer Herstellung verbinden.
MOs gegen Bonding:
- Antibonding-Wechselwirkungen zwischen Atomorbitalen sind destruktive (phasenverschobene) Wechselwirkungen.
- Antibonding-MOs sind energiereicher als die Atomorbitale, die sie zusammen erzeugen.
Nicht bindende MOs:
- Nicht bindende MOs sind das Ergebnis einer fehlenden Wechselwirkung zwischen Atomorbitalen, da es keine kompatiblen Symmetrien gibt.
- Nicht bindende MOs haben die gleiche Energie wie die Atomorbitale eines der Atome im Molekül.
HOMO und LUMO
Jedes Molekülorbital hat sein eigenes Energieniveau. Chemiker sortieren die MOs nach Energieniveaus. Die Chemiker gehen davon aus, dass die Elektronen zuerst das niedrigste Energieniveau MOs füllen werden. Wenn zum Beispiel ein Molekül Elektronen hat, um 15 Orbitale zu füllen, werden die 15 MOs mit den niedrigsten Energieniveaus gefüllt. Der 15. MO auf der Liste würde als "höchstes besetztes Molekülorbital" (HOMO) und der 16. MO auf der Liste als "niedrigstes unbesetztes Molekülorbital" (LUMO) bezeichnet. Der Unterschied zwischen dem Energieniveau des HOMO und dem Energieniveau des LUMO wird als Bandlücke bezeichnet. Die Bandlücke kann manchmal als Maß für die Erregbarkeit des Moleküls dienen: je kleiner die Energie, desto leichter wird das Molekül angeregt. Wenn das Elektron angeregt wird, springt es auf ein unbesetztes MO. Dies kann zum Beispiel helfen zu erraten, ob etwas Licht ausstrahlt (Lumineszenz).
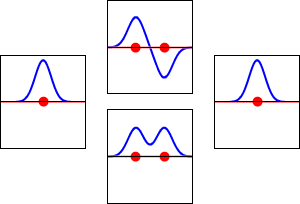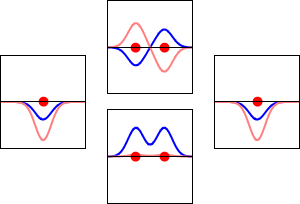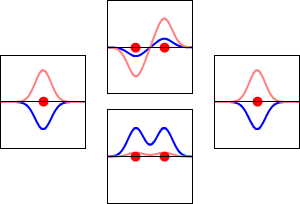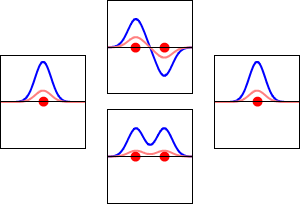
Elektronenwellenfunktionen für das 1s-Orbital des Wasserstoffatoms (links und rechts) und die entsprechenden bindenden (unten) und antikörperbindenden (oben) Molekülorbitale des H2-Moleküls. Der Realteil der Wellenfunktion ist die blaue Kurve, und der Imaginärteil ist die rote Kurve. Die roten Punkte markieren die Positionen der Protonen. Die Elektronenwellenfunktion schwingt nach der Schrödinger-Wellengleichung, und die Orbitale sind ihre stehenden Wellen. Die Frequenz der stehenden Wellen ist proportional zur Energie des Orbitals. (Diese Darstellung ist ein eindimensionaler Schnitt durch das dreidimensionale System).
Fragen und Antworten
F: Was ist ein molekulares Orbital?
A: Ein Molekularorbital (oder MO) ist eine mathematische Funktion, die das wellenförmige Verhalten eines Elektrons in einem Molekül beschreibt. Es erklärt, was mit den Elektronen passiert, wenn sich Atome in einem Molekül zusammenschließen und kann die Wahrscheinlichkeit angeben, dass sich ein Elektron in einer bestimmten Region befindet.
F: Wie bauen Chemiker mathematische Modelle von Molekülorbitalen auf?
A: Chemiker erstellen in der Regel mathematische Modelle von Molekülorbitalen, indem sie atomare Orbitale kombinieren. Es können auch Hybridorbitale von jedem Atom des Moleküls oder andere Molekularorbitale von Atomgruppen verwendet werden. Computer können mit diesen Funktionen arbeiten.
F: Was hat die Quantenmechanik mit der Untersuchung von Molekülen zu tun?
A: Molekulare Orbitale ermöglichen es Chemikern, die Quantenmechanik bei der Untersuchung von Molekülen anzuwenden. Sie beantworten Fragen darüber, wie die Atome in Molekülen zusammenhalten, und geben Aufschluss über chemische und physikalische Eigenschaften.
F: Was sind Orbitaldiagramme?
A: Orbitaldiagramme sind visuelle Darstellungen, die zeigen, wo sich die Elektronen in einem Atom auf der Grundlage seiner verschiedenen runden Formen am wahrscheinlichsten befinden.
F: Wie funktionieren hybride Orbitale?
A: Hybridorbitale kombinieren verschiedene Arten von Atomorbitalen zu einem neuen Typ, der im Vergleich zu seinen Bestandteilen einzigartige Eigenschaften aufweist. Diese Hybridorbitale werden häufig bei der Erstellung mathematischer Modelle für Molekülorbitale verwendet.
F: Wie können Computer bei der Untersuchung von MOs helfen?
A: Computer können bei der Untersuchung von MOs helfen, indem sie ihre Funktionen untersuchen und genauere Vorhersagen oder Erklärungen für chemische und physikalische Eigenschaften in Molekülen liefern.
Suche in der Enzyklopädie