Elektrozyklische Reaktion
In der organischen Chemie ist eine elektrozyklische Reaktion eine Art perizyklische Umlagerungsreaktion. Die Reaktion ist elektrozyklisch, wenn das Ergebnis ist, dass eine pi-Bindung zu einer Sigma-Bindung oder eine Sigma-Bindung zu einer pi-Bindung wird. Elektrozyklische Reaktionen haben die folgenden Eigenschaften gemeinsam:
- elektrozyklische Reaktionen werden durch Licht (photoinduziert) oder Wärme (thermisch) ausgelöst
- der Reaktionsmodus wird durch die Anzahl der pi-Elektronen in dem Teil mit mehr pi-Bindungen bestimmt
- eine elektrozyklische Reaktion kann einen Ring schließen (Elektrozyklisierung) oder einen Ring öffnen
- Die Stereospezifität wird durch eine conrotatorische oder disrotatorische Übergangszustandsbildung bestimmt, wie sie durch die Woodward-Hoffmann-Regeln vorhergesagt wird.
Die Drehmomentselektivität in einer elektrozyklischen Reaktion bezieht sich auf die Drehrichtung der Substituenten. Beispielsweise können sich die Substituenten in einer Reaktion, die rotierend abläuft, noch in zwei Richtungen drehen. Dabei entsteht ein Gemisch aus zwei spiegelbildlich zueinander stehenden Produkten (Enantiomerenprodukte). Eine Reaktion, die drehmomentabhängig ist, schränkt eine dieser Drehrichtungen (teilweise oder vollständig) ein, um ein Produkt im Enantiomeren-Überschuss zu erzeugen (wobei ein Stereoisomer viel mehr produziert wird als das andere).
Chemiker interessieren sich für elektrozyklische Reaktionen, weil die Geometrie der Moleküle eine Reihe von Vorhersagen der theoretischen Chemiker bestätigt. Sie bestätigen die Erhaltung der molekularen Bahnsymmetrie.
Die Nazarov-Zyklisierungsreaktion ist eine elektrozyklische Reaktion, die einen Ring schließt. Dabei werden Divinylketone in Cyclopentenone umgewandelt. (Sie wurde von Iwan Nikolajewitsch Nasarow (1906-1957) entdeckt).
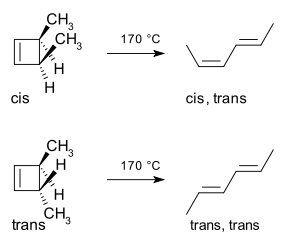
Ein Beispiel ist die thermische Ringöffnungsreaktion von 3,4-Dimethylcyclobuten. Das cis-Isomer liefert nur cis,trans-2,4-Hexadien. Das trans-Isomer ergibt jedoch das trans,trans-Dien:
Die frontier-orbitale Methode erklärt, wie diese Reaktion abläuft. Die Sigma-Bindung im Reaktanten öffnet sich so, dass die resultierenden p-Orbitale die gleiche Symmetrie aufweisen wie das höchste besetzte Molekülorbital (HOMO) des Produkts (ein Butadien). Dies kann nur bei einer rotatorischen Ringöffnung geschehen, die zu entgegengesetzten Vorzeichen für die beiden Lappen an den gebrochenen Enden des Rings führt. (Eine disrotatorische Ringöffnung würde eine Anti-Bindung bilden.) Das folgende Diagramm zeigt dies:
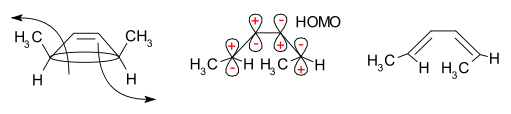
Die Stereospezifität des Ergebnisses hängt davon ab, ob die Reaktion durch einen rotatorischen oder disrotatorischen Prozess verläuft.
Woodward-Hoffman-Regeln
Die Woodward-Hoffmann-Regeln befassen sich mit der Erhaltung der Bahnsymmetrie bei elektrozyklischen Reaktionen.

Korrelationsdiagramme verbinden die Molekülorbitale des Reaktanten mit denen des Produkts, das die gleiche Symmetrie aufweist. Korrelationsdiagramme können für die beiden Prozesse gezeichnet werden.
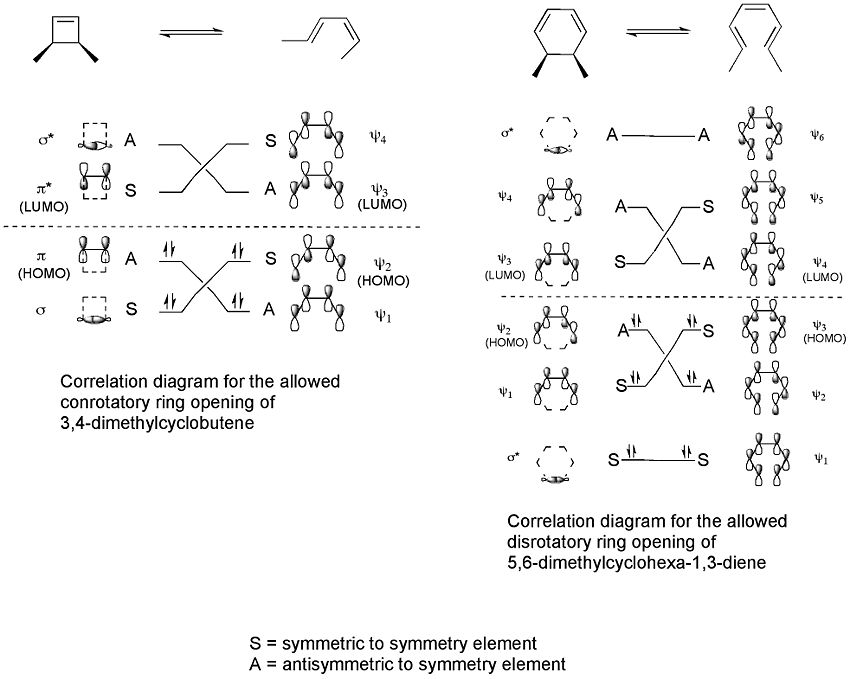
Diese Korrelationsdiagramme weisen darauf hin, dass nur eine rotatorische Ringöffnung von 3,4-Dimethylcyclobuten "Symmetrie erlaubt" ist, während nur eine disrotatorische Ringöffnung von 5,6-Dimethylcyclohexa-1,3-dien "Symmetrie erlaubt" ist. Dies liegt daran, dass nur in diesen Fällen eine maximale orbitale Überlappung im Übergangszustand auftreten würde. Ausserdem würde sich das geformte Produkt in einem Grundzustand und nicht in einem angeregten Zustand befinden.
Molekulare Grenzumlaufbahntheorie
Die Frontier Molecular Orbital Theory sagt voraus, dass sich die Sigma-Bindung im Ring so öffnet, dass die resultierenden p-Orbitale die gleiche Symmetrie wie das HOMO des Produkts aufweisen.
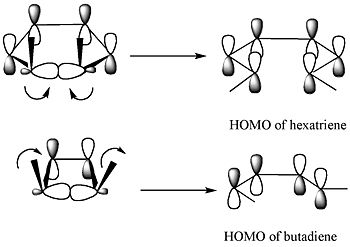
Das obige Diagramm zeigt zwei Beispiele. Für das 5,6-Dimethylcyclohexa-1,3-dien (obere Reihe des Diagramms) würde nur ein disrotatorischer Modus dazu führen, dass die p-Orbitale die gleiche Symmetrie wie das HOMO des Hexatriens aufweisen. Die beiden p-Orbitale rotieren in entgegengesetzten Richtungen. Für das 3,4-Dimethylcyclobuten (untere Reihe des Diagramms) würde nur ein disrotatorischer Modus zu p-Orbitalen führen, die dieselbe Symmetrie wie das HOMO von Butadien aufweisen. Die p-Orbitale rotieren in der gleichen Richtung.
Elektrozyklisierungen im angeregten Zustand
Licht kann ein Elektron in einen angeregten Zustand bringen, der ein höheres Orbital einnimmt. Das angeregte Elektron wird den LUMO besetzen, der ein höheres Energieniveau hat als das alte Orbital des Elektrons. Wenn Licht den Ring des 3,4-Dimethylcyclobutens öffnet, würde die resultierende Elektrozyklisierung durch einen disrotatorischen statt durch einen konrotatorischen Modus erfolgen. Das Korrelationsdiagramm für die erlaubte Ringöffnungsreaktion im angeregten Zustand zeigt, warum:
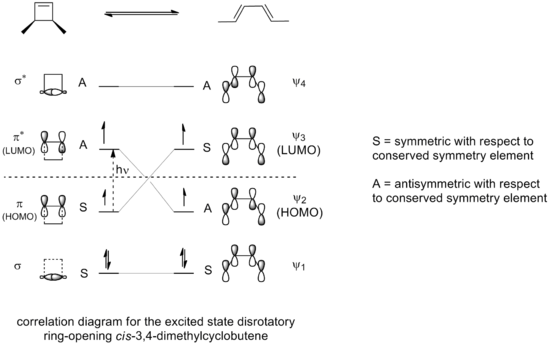
Nur ein disrotatorischer Modus, bei dem die Symmetrie um eine Reflexionsebene während der gesamten Reaktion erhalten bleibt, würde zu einer maximalen orbitalen Überlappung im Übergangszustand führen. Auch dies würde wiederum zur Bildung eines Produkts führen, das sich in einem angeregten Zustand von vergleichbarer Stabilität wie der angeregte Zustand der Reaktantenverbindung befindet.
Elektrozyklische Reaktionen in biologischen Systemen
Elektrozyklische Reaktionen treten in der Natur häufig auf. Eine der häufigsten derartigen Reaktionen in der Natur ist die Biosynthese von Vitamin D3.
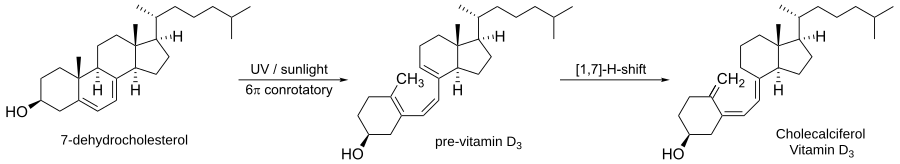
Im ersten Schritt wird der Ring des 7-Dehydrocholesterins durch Licht geöffnet, um Prävitamin D3 zu bilden. Dies ist eine photochemisch induzierte, konrotatorische, elektrozyklische Reaktion. Der zweite Schritt ist ein [1,7]-Hydrid-Shift zur Bildung von Vitamin D3.
Ein weiteres Beispiel ist die vorgeschlagene Biosynthese von Aranotin, einem in der Natur vorkommenden Oxepin, und seinen verwandten Verbindungen.
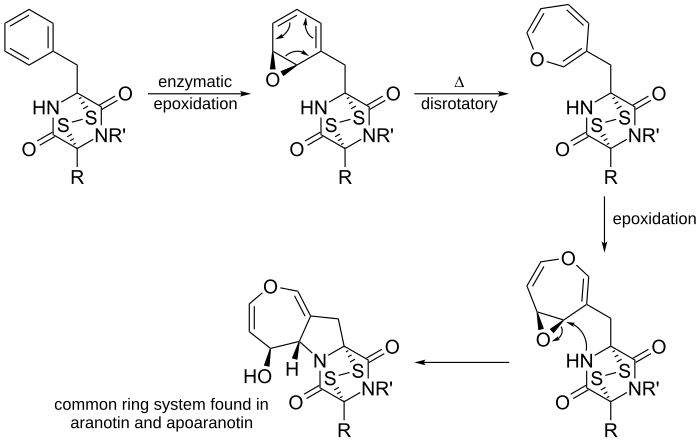
Phenylalanin wird zur Herstellung von Diketopiperazin verwendet (nicht abgebildet). Dann epoxidieren Enzyme Diketopiperazin, um das Arenoxid herzustellen. Dieses wird einer 6π disrotatorischen Ringöffnungs-Elektrozyklisierungsreaktion unterzogen, um das nicht zyklisierte Oxepin herzustellen. Nach einer zweiten Epoxidierung des Rings greift der nahe gelegene nukleophile Stickstoff den elektrophilen Kohlenstoff an und bildet einen fünfgliedrigen Ring. Das resultierende Ringsystem ist ein übliches Ringsystem, das in Aranotin und seinen verwandten Verbindungen vorkommt.
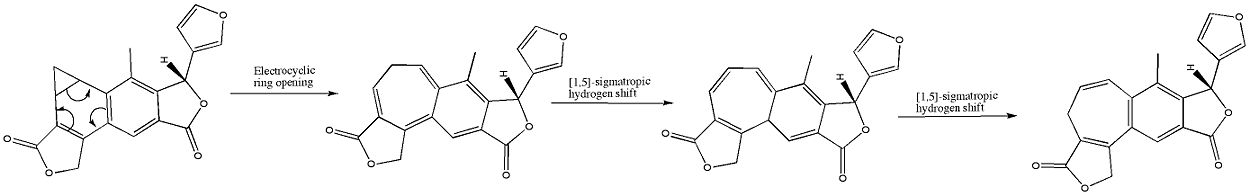
Das Benzonorcaradien-Diterpenoid (A) wurde durch Sieden einer Methylenchloridlösung in das Benzocycloheptatrien-Diterpenoid Isosalvipuberlin (B) umgelagert. Diese Umwandlung kann man sich als eine disrotatorische elektrozyklische Reaktion vorstellen, gefolgt von zwei suprafazialen 1,5-sigmatropen Wasserstoffverschiebungen, wie unten dargestellt:
Geltungsbereich
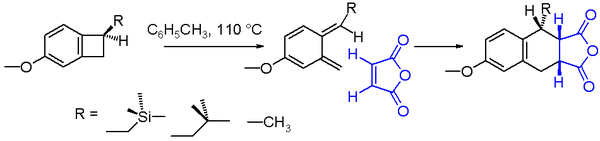
Ein Beispiel für eine elektrozyklische Reaktion ist die rotatorische thermische Ringöffnung von Benzocyclobutan. Das Reaktionsprodukt ist ein sehr instabiles ortho-Chinodimethan. Dieses Molekül kann in einer Endoaddition mit einem starken Dienophil wie Maleinsäureanhydrid an das Diels-Alder-Addukt eingeschlossen werden. Die chemische Ausbeute für die Ringöffnung des in Schema 2 dargestellten Benzocyclobutans hängt von der Art des Substituenten R ab. Mit einem Reaktionslösungsmittel wie Toluol und einer Reaktionstemperatur von 110 °C steigt die Ausbeute von Methyl über Isobutylmethyl bis Trimethylsilylmethyl. Die erhöhte Reaktionsgeschwindigkeit für die Trimethylsilylverbindung lässt sich durch Silizium-Hyperkonjugation erklären, da die βC-Si-Bindung die Cyclobutan-C-C-Bindung durch Elektronenabgabe schwächt.
Eine biomimetische elektrozyklische Kaskadenreaktion wurde im Zusammenhang mit der Isolierung und Synthese bestimmter Endiandrinsäuren entdeckt:

Fragen und Antworten
F: Was ist eine elektrozyklische Reaktion?
A: Eine elektrozyklische Reaktion ist eine Art perizyklische Umlagerungsreaktion, bei der eine pi-Bindung zu einer sigma-Bindung oder eine sigma-Bindung zu einer pi-Bindung wird.
F: Wie werden elektrozyklische Reaktionen angetrieben?
A: Elektrozyklische Reaktionen werden durch Licht (photoinduziert) oder Wärme (thermisch) angetrieben.
F: Wie wirkt sich die Anzahl der pi-Elektronen auf eine elektrozyklische Reaktion aus?
A: Die Anzahl der pi-Elektronen beeinflusst den Reaktionsmodus bei einer elektrozyklischen Reaktion.
F: Was geschieht während einer Elektrozyklisierung?
A: Während einer Elektrozyklisierung kann ein Ring geschlossen werden.
F: Wodurch wird die Stereospezifität bei einer elektrozyklischen Reaktion bestimmt?
A: Die Stereospezifität in einer elektrozyklischen Reaktion wird durch eine konrotatorische oder disrotatorische Übergangszustandsbildung bestimmt, wie sie durch die Woodward-Hoffmann-Regeln vorhergesagt wird.
Q: Was ist Torquoselektivität in Bezug auf eine elektrozyklische Reaktion?
A: Torquoselektivität bezieht sich auf die Drehrichtung der Substituenten während einer elektrozyklischen Reaktion, die enantiomere Produkte erzeugen kann, wenn sie durch einen konrotatorischen Prozess abläuft, und einen Enantiomerenüberschuss, wenn sie durch einen torquoselektiven Prozess abläuft.
Q:Welches Beispiel veranschaulicht, wie die Frontier-Orbital-Methode diese Funktionsweise erklärt?
A:Die thermische Ringöffnungsreaktion von 3,4-Dimethylcyclobuten ist ein Beispiel dafür, wie die Frontier-Orbital-Methode erklärt, wie dies funktioniert. Die Sigma-Bindung wird sich so öffnen, dass die entstehenden p-Orbitale die gleiche Symmetrie aufweisen wie das höchstbesetzte Molekülorbital (HOMO) des Produkts (ein Butadien). Dies geschieht nur bei einer konrotatorischen Ringöffnung, die zu entgegengesetzten Vorzeichen für die beiden Lappen an den gebrochenen Enden des Rings führt, während eine disrotatorische Bindung eine Anti-Bindung bilden würde.
Suche in der Enzyklopädie