Metallorganische Chemie
Die metallorganische Chemie ist die Untersuchung von chemischen Verbindungen, die Bindungen zwischen Kohlenstoff und einem Metall enthalten. Sie kombiniert Aspekte der anorganischen Chemie (die Untersuchung von Nicht-Kohlenstoff-Bindungen) und der organischen Chemie (die Untersuchung von Kohlenstoff-Bindungen).
Beispiele für organometallische Verbindungen sind Tetraethylblei; es wurde in der Vergangenheit als Kraftstoffzusatz (verbleites Benzin) verwendet. Auch Methylcobalamin (Vitamin B12) ist eine häufige organometallische Verbindung.
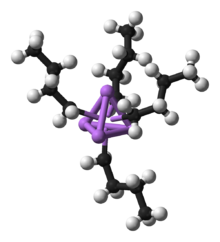
n-Butyllithium , eine organometallische Verbindung. Vier Lithiumatome sind in einem Tetraeder violett dargestellt, und jedes Lithiumatom ist an eine Butylgruppe gebunden (Kohlenstoff ist schwarz, Wasserstoff ist weiß)
Organometallische Verbindungen
Organometallverbindungen sind Verbindungen, die chemische Bindungen zwischen einem oder mehreren Metallatomen und einem oder mehreren Kohlenstoffatomen einer Organylgruppe (einem organischen Liganden) aufweisen. Sie haben die Vorsilbe "organo-" (organischer Ligand). (zum Beispiel Organopalladiumverbindungen). Zu den Organometallverbindungen gehören Untergruppen wie die Metalloproteine, z.B. Hämoglobin.
Der Begriff "Metallorganika" bezieht sich gewöhnlich auf metallhaltige Verbindungen ohne direkte Metall-Kohlenstoff-Bindungen, die jedoch organische Liganden enthalten, die sie an eine organische Verbindung binden. Metallbeta-Diketonate, -alkoxide und -dialkylamide gehören zu dieser Klasse.
Zusätzlich zu den traditionellen Metallen bilden Elemente wie Bor, Silizium, Arsen und Selen organometallische Verbindungen.
Koordinationsverbindungen mit organischen Liganden
Viele Komplexe weisen Koordinationsbindungen zwischen einem Metall und organischen Liganden auf. Die organischen Liganden binden das Metall oft über ein Heteroatom wie Sauerstoff oder Stickstoff, in diesem Fall werden solche Verbindungen "Koordinationsverbindungen" genannt.
In der Natur kommen viele organische Koordinationsverbindungen vor. Zum Beispiel enthalten Hämoglobin und Myoglobin ein Eisenzentrum, das an die Stickstoffatome eines Porphyrinrings koordiniert ist; Magnesium ist das Zentrum eines Chlorinrings im Chlorophyll. Der Bereich solcher anorganischen Verbindungen wird als bioanorganische Chemie bezeichnet. Methylcobalamin (eine Form von Vitamin B12) mit einer Kobalt-Methyl-Bindung ist jedoch ein echter organometallischer Komplex, einer der wenigen in der Biologie bekannten.
Struktur und Eigenschaften
Die Metall-Kohlenstoff-Bindung in metallorganischen Verbindungen liegt auf halbem Weg zwischen ionisch und kovalent. Metallorganische Verbindungen mit Bindungen, deren Charakter zwischen ionisch und kovalent liegt, sind in der Industrie sehr wichtig. Sie sind beide relativ stabil in Lösungen, aber ionisch genug, um Reaktionen einzugehen. Zwei wichtige Klassen sind Organolithium- und Grignard-Reagenzien.
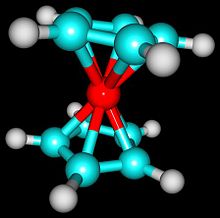
Das Metall Fe (rot) bindet zwei organische Ringe aneinander. In den Ringstrukturen stellt jeder Punkt ein Kohlenstoffatom dar. Ferrocen hat also 10 Kohlenstoffatome, 5 im Ring oberhalb des Eisens und 5 im Ring unterhalb
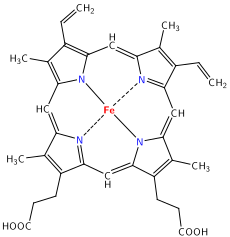
Hämoglobin-Gruppe des Hämoglobins
Verwendet
Metallorganische Verbindungen finden praktische Anwendung bei stöchiometrischen und katalytischen Prozessen, insbesondere bei Prozessen mit Kohlenmonoxid und von Alkenen abgeleiteten Polymeren. Alle Polyethylen- und Polypropylenprodukte der Welt werden mit metallorganischen Katalysatoren hergestellt. Essigsäure wird unter Verwendung von Metallcarbonylkatalysatoren im Monsanto-Prozess und im Cativa-Prozess hergestellt. Der Großteil der synthetischen Alkohole, zumindest diejenigen, die größer als Ethanol sind, werden durch Hydrierung von Aldehyden hergestellt, die von der Hydroformylierung abgeleitet sind. In ähnlicher Weise wird das Wacker-Verfahren bei der Oxidation von Ethylen zu Acetaldehyd eingesetzt.
Organomettalic sind sehr einfach und stark reduzierend. Sie katalysieren viele Polymerisationsreaktionen. Sie sind auch stöchiometrisch nützlich.
Metallorganische Verbindungen können in der Umwelt gefunden werden. Umweltschützer machen sich Sorgen über blei- und quecksilberorganische Verbindungen. Sie stellen toxische Gefahren dar.
Gegenwärtig wird mit Hilfe der organometallischen Katalyse geforscht. Die Energiekrise hat das Interesse an einer effizienteren Nutzung der uns noch verbliebenen fossilen Brennstoffe verstärkt. Viele sind sich zwar einig, dass die Verringerung der Ölabhängigkeit sowohl für die Umwelt sicherer als auch politisch klug ist. Das neue Interesse an "grünen" Technologien hat auch zu einer verstärkten Forschung beigetragen. Viele Beispiele für organometallische Forschung finden sich in der petrochemischen und pharmazeutischen Industrie. Einige der derzeitigen Methoden der chemischen Produktion sind verschwenderisch und erzeugen giftige Abfälle, während viele metallorganische Katalysatoren vielversprechend sind, dies zu ändern.
Geschichte
Louis Claude Cadet synthetisierte Methylarsenverbindungen, die mit Kakodyl verwandt sind. William Christopher Zeise stellte Platin-Ethylen-Komplex her. Edward Frankland entdeckte Dimethylzink. Ludwig Mond entdeckte Ni(CO)4. Victor Grignard arbeitete mit Organomagnesiumverbindungen. Die reichlich vorhandenen und vielfältigen Produkte aus Kohle und Erdöl führten zur Ziegler-Natta-, Fischer-Tropsch- und Hydroformylierungskatalyse, die CO, H2 und Alkene als Ausgangsstoffe und Liganden verwenden.
Vor Jahren wurde dem Benzin Tetraethylblei als Antiklopfmittel zugesetzt. Da Blei giftig ist, wird es in Benzin nicht mehr verwendet. Stattdessen werden jetzt andere organometallische Verbindungen wie Ferrocen und Methylcyclopentadienylmangantricarbonyl (MMT) dem Benzin zugesetzt, um Klopfen zu verhindern.
Die 1973 an Ernst Fischer und Geoffrey Wilkinson verliehenen Nobelpreise für Arbeiten über Metallocene machten die organometallische Chemie populärer. Im Jahr 2005 teilten sich Yves Chauvin, Robert H. Grubbs und Richard R. Schrock den Nobelpreis für die metallkatalysierte Olefinmetathese.
Zeitleiste der metallorganischen Chemie
- 1760 Louis Claude Cadet de Gassicourt untersucht Tinten auf der Basis von Kobaltsalzen und isoliert Cacodyl aus arsenhaltigem Kobaltmineral
- 1827 Das Zeisesalz ist der erste Platin/Olefin-Komplex
- 1848 Edward Frankland entdeckt Diethylzink
- 1863 Charles Friedel und James Crafts stellen Organochlorsilane her
- 1890 Ludwig Mond entdeckt Nickelcarbonyl
- 1899 Einführung der Grignard-Reaktion
- 1900 Paul Sabatier arbeitet an der Hydrierung organischer Verbindungen mit Metallkatalysatoren. Die Hydrierung von Fetten ist der Startschuss für Fortschritte in der Lebensmittelindustrie, siehe Margarine
- 1909 Paul Ehrlich führt Salvarsan zur Behandlung von Syphilis ein, eine frühe auf Arsen basierende organometallische Verbindung
- 1912 Nobelpreis Victor Grignard und Paul Sabatier
- 1930 Henry Gilman arbeitet an Lithium-Cupraten, siehe Gilman-Reagenz
- 1951 Ferrocen wird entdeckt
- 1963 Nobelpreis für Karl Ziegler und Giulio Natta für Ziegler-Natta-Katalysator
- 1965 Entdeckung von Cyclobutadien-Eisen-Tricarbonyl
- 1968 Heck-Reaktion
- 1973 Nobelpreis Geoffrey Wilkinson und Ernst Otto Fischer für Sandwich-Verbindungen
- 1981 Nobelpreis Roald Hoffmann und Kenichi Fukui für das Isolobal-Prinzip
- 2005 Nobelpreisträger Yves Chauvin, Robert Grubbs und Richard R. Schrock über die metallkatalysierte Alkenmetathese
- 2010 Nobelpreis Richard F. Heck, Ei-ichi Negishi, Akira Suzuki für ihre Arbeiten über palladiumkatalysierte Kopplungsreaktionen in der organischen Synthese.
Verwandte Seiten
- Chelation
Suche in der Enzyklopädie